2021-2022学年湖北省武汉市武昌区水果湖高中高二(上)月考化学试卷(12月份)
发布:2024/9/12 10:0:8
一、单选题
-
1.下列关于电解质电离的叙述中正确的是( )
组卷:3引用:1难度:0.5 -
2.25℃时,水的电离达到平衡:H2O⇌H++OH-△H>0,下列叙述正确的是( )
组卷:9引用:3难度:0.7 -
3.常温条件下,0.1mol/LNaCN溶液与0.05mol/LHCl溶液等体积混合后,溶液微粒浓度排序正确的是( )(已知HCN的电离平衡常数Ka=6.2×10-10)
组卷:79引用:4难度:0.6 -
4.广义的水解观认为:无论是盐的水解还是非盐的水解,其最终结果是反应中各物质和水分别离解成两部分,然后两两重新组合成新的物质。根据上述观点,说法不正确的是( )
组卷:122引用:3难度:0.8 -
5.下列溶液中离子浓度关系表示正确的是( )
组卷:238引用:16难度:0.5 -
6.如图是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法。已知:室温饱和H2S溶液的pH约为3.9,SnS沉淀完全时溶液的pH为1.6,FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5。根据如图所示流程图,下列说法错误的是( )
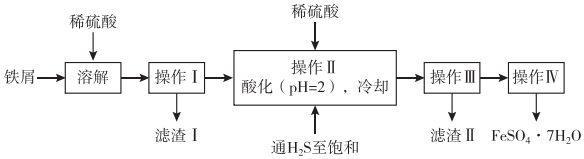 组卷:22引用:4难度:0.7
组卷:22引用:4难度:0.7
二、解答题(共4小题,满分0分)
-
18.氯化亚铜是一种白色粉末,难溶于水,溶于浓盐酸生成氯亚铜酸,常用作催化剂、杀菌剂。以辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2 等杂质)和软锰矿(主要成分MnO2)为原料制备碱式碳酸铜,并进一步制取氯化亚铜 (CuCl)的工艺流程如图:
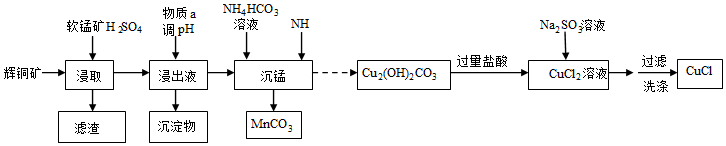
已知:①CS2的沸点为46.2℃
②常温下几种物质开始沉淀与完全沉淀时的pH如表
请回答下列问题:金属离子 Fe2+ Fe3+ Cu2+ Mn2+ 开始沉淀 7.5 2.7 5.6 8.3 完全沉淀 9.0 3.7 6.7 9.8
(1)为加快“浸取”速率,除将辉铜矿粉碎外,还可采取的措施有(任写一种),浸取过程中得到一种单质,写出主要反应的化学方程式,该单质可用CS2提取回收,回收过程中温度应控制在40℃~45℃之间,不宜过高的原因是。
(2)调节pH的范围为,物质a可选用(填序号)。
A.CuO
B.Fe2O3
C.CuCO3
D.MnO2
(3)“沉锰”时发生反应的离子方程式。
(4)得到的CuCl晶体需用水洗,判断晶体是否洗涤干净的操作是。组卷:22引用:2难度:0.6 -
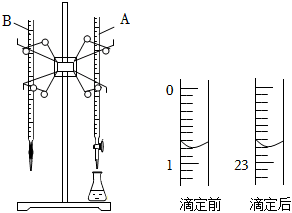 19.酸碱反应是生产生活实际中常见的反应之一。如图是用0.1000mol/L的盐酸滴定某未知浓度的NaOH溶液的示意图和某次滴定前、后盛放盐酸的滴定管中液面的位置。
19.酸碱反应是生产生活实际中常见的反应之一。如图是用0.1000mol/L的盐酸滴定某未知浓度的NaOH溶液的示意图和某次滴定前、后盛放盐酸的滴定管中液面的位置。
请回答下列问题;
(1)仪器A的名称是。
(2)依上图所示,此次滴定盐酸消耗的体积为mL。
(3)某实验小组同学的三次实验的实验数据如下表所示。①此次滴定时选择的指示剂为,②则待测NaOH溶液的平均浓度是mol/L(保留四位有效数字)
(4)对下列实验过程,因操作不正确而引起的误差,使待测NaOH溶液浓度偏高的有实验编号 待测NaOH溶液的体积/mL 滴定前盐酸的体积读数/mL 滴定后盐酸的体积读数/mL 1 20.00 1.20 23.22 2 20.00 1.21 29.21 3 20.00 1.50 23.48 (填序号)。
①酸式滴定管水洗后在装液前未用标准盐酸润洗2~3次
②开始实验时酸式滴定管尖嘴部分有气泡,在滴定过程中气泡消失
③锥形瓶未干燥,有少量蒸馏水
④盛NaOH溶液的锥形瓶滴定前用NaOH溶液润洗2~3次
⑤放出碱液的滴定管开始有气泡,放出液体后气泡消失
⑥溶液颜色较浅时滴入酸液过快,停止滴定后反加一滴NaOH溶液,颜色无变化
⑦酸式滴定管滴定前仰视读数,滴定后俯视读数
⑧振荡锥形瓶时部分液体溅出
(5)某实验小组为测定某固体样品中(NH4)2Fe(SO4)2•6H2O的含量,该物质的摩尔质量为392g.mol-1,做了如下实验:
测定原理:MnO4-+Fe2++H+→Mn2++Fe3++H2O(方程式未配平)
测定步骤:步骤一,准确称量20.00g样品,配制成100mL溶液。步骤二,取所配溶液25.00mL于锥形瓶中,加稀H2SO4酸化,用0.1000mol•L−1 KMnO4溶液滴定至终点,重复两次,平均消耗KMnO4溶液16.00mL。
①如何判断到达滴定终点?。
②产品中(NH4)2Fe(SO4)2•6H2O的质量分数为%(保留到小数点后一位)组卷:104引用:2难度:0.5


