2023年天津市南开中学高考化学模拟试卷(5月份)
发布:2024/5/15 8:0:8
一、单选题
-
1.下列说法正确的是( )
组卷:87引用:2难度:0.7 -
2.设NA为阿伏加德罗常数的值。下列说法正确的是( )
组卷:91引用:3难度:0.6 -
3.下列事实不能说明氯元素的非金属性比硫元素的非金属性强的是( )
组卷:98引用:3难度:0.7 -
4.我国嫦娥五号探测器带回月球土壤样本,经分析发现其构成与地球土壤类似。土壤中含有短周期元素W、X、Y、Z,原子序数依次增大,最外层电子数之和为15。X、Y、Z为同周期相邻元素,且均不与W同族,下列结论正确的是( )
组卷:119引用:2难度:0.7 -
5.完成下列实验所选择的装置正确的是( )
A B C D 实验 除去乙醇中的苯酚 除去实验室所制乙烯中的少量SO2 蒸干NH4Cl饱和溶液制备NH4Cl晶体 制取少量纯净的CO2气体 装置 


 组卷:82引用:5难度:0.6
组卷:82引用:5难度:0.6
四、实验题
-
 15.一水硫酸四氨合铜晶体[Cu(NH3)4SO4•H2O,相对分子质量为246]是一种重要的染料及农药中间体。常温下该物质可溶于水,难溶于乙醇。某化学兴趣小组通过以下实验制备一水硫酸四氨合铜晶体并测定其纯度。回答相关问题:
15.一水硫酸四氨合铜晶体[Cu(NH3)4SO4•H2O,相对分子质量为246]是一种重要的染料及农药中间体。常温下该物质可溶于水,难溶于乙醇。某化学兴趣小组通过以下实验制备一水硫酸四氨合铜晶体并测定其纯度。回答相关问题:
Ⅰ.实验室制取CuSO4溶液
方案i:铜与浓硫酸加热制备。
方案ii:将铜粉在空气中充分加热至完全变黑,再加稀硫酸即可得到硫酸铜溶液。
(1)请写出方案i反应的化学方程式,其缺点是(写1点)。
(2)实际生产中方案ii常常有紫红色固体未反应,猜想原因可能是。
(3)基于此,实验进行了改进,其中一种方案是在硫酸和铜的反应容器中滴加H2O2溶液,观察到的现象是(写1点)。H2O2的沸点为150.2℃.为加快反应需要提高H2O2溶液的浓度,可通过图将H2O2稀溶液浓缩,冷水入口是(填a或b),增加减压设备的目的是。
Ⅱ.一水硫酸四氨合铜晶体的制备
(4)硫酸铜溶液含有一定的硫酸,呈酸性,加入适量NH3•H2O调节溶液pH,产生浅蓝色沉淀,已知其成分为Cu2(OH)2SO4,试写出生成此沉淀的离子反应方程式。
(5)继续滴加NH3•H2O,会转化成深蓝色溶液。从深蓝色溶液中析出深蓝色晶体的简便实验是滴加。
Ⅲ.产品纯度的测定
(6)精确称取mg晶体,加适量水溶解,然后逐滴加入足量NaOH溶液,通入水蒸气将氨全部蒸出,用V1mL0.200mol•L-1的盐酸完全吸收。以甲基橙作指示剂,用0.200mol•L-1NaOH标准溶液滴定过剩的HCl,到终点时消耗V2mL NaOH溶液。产品纯度的表达式为。组卷:101引用:4难度:0.5
五、原理综合题
-
16.H2S和SO2会对环境和人体健康带来极大的危害,工业上采取多种方法减少这些有害气体的排放,回答下列方法中的问题。
Ⅰ.H2S的除去
方法1:生物脱H2S的原理为:
H2S+Fe2(SO4)3═S↓+2FeSO4+H2SO4
4FeSO4+O2+2H2SO42Fe2(SO4)3+2H2O硫杆菌
(1)硫杆菌存在时,FeSO4被氧化的速率是无菌时的5×105倍,该菌的作用是。
(2)由图1和图2判断使用硫杆菌的最佳条件为。若反应温度过高,反应速率下降,其原因是。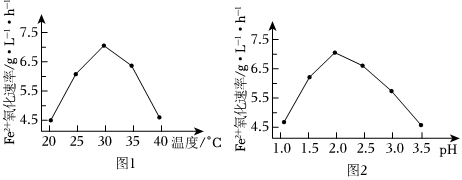
方法2:在一定条件下,用H2O2氧化H2S
(3)随着参加反应的n(H2O2)/n(H2S)变化,氧化产物不同。当n(H2O2)/n(H2S)=4时,氧化产物的分子式为。
Ⅱ.SO2的除去
方法1(双碱法):用NaOH吸收SO2,并用CaO使NaOH再生
NaOH溶液Na2SO3溶液①SO2②CaO
(4)写出过程①的离子方程式:;CaO在水中存在如下转化:
CaO(s)+H2O (l)═Ca(OH)2(s)⇌Ca2+(aq)+2OH-(aq)
从平衡移动的角度,简述过程②NaOH再生的原理。
方法2:用氨水除去SO2
(5)已知25℃,NH3•H2O的Kb=1.8×10-5,H2SO3的Ka1=1.3×10-2,Ka2=6.2×10-8.若氨水的浓度为2.0mol•L-1,溶液中的c(OH-)=mol•L-1.将SO2通入该氨水中,当c(OH-)降至1.0×10-7 mol•L-1时,溶液中的c()/c(SO2-3)=HSO-3。组卷:1194引用:13难度:0.5


