当前位置:
章节挑题
请展开查看知识点列表
>
更多>>
 已完结
已完结
|
热点预测
中考复习
热搜题专练
浏览次数:40
更新:2025年04月27日
|
 已完结
已完结
|
热点预测
高考复习
新题抢练
浏览次数:233
更新:2025年04月25日
|
871.下列有关热化学方程式的评价合理的是( )
实验事实 热化学方程式 评价 A 已知H+(aq)+OH-(aq)=H2O(l)△H=-57.3 kJ•mol-1,将稀硫酸与 稀氢氧化钡溶液混合 H2SO4(aq)+Ba(OH)2(aq)=BaSO4(s)+2H2O(l)
△H=-114.6 kJ•mol-1
正确B 稀醋酸与稀氢氧化钠溶液混合 CH3COOH(aq)+NaOH(aq)=NaCl(aq)+H2O(l)
△H=-57.3k J•mol-1不正确;因为醋酸状态为“l”,而不是“aq”. C 160 g SO3气体与适量水恰好完全反应生成H2SO4,放出热量260.6 kJ SO3(g)+H2O(l)=H2SO4(aq)△H=-130.3 kJ•mol-1 不正确;因为反应热为△H=-260.6 kJ•mol-1 D 已知25℃、101 kPa下,120g石墨完全燃烧放出热量3935.1 kJ C(s)+O2(g)=CO2(g)
△H=-393.51 kJ•mol-1不正确;同素异形体要注名称:C(石墨,S) 发布:2024/4/20 14:35:0组卷:343引用:9难度:0.9 872.一种高性能的碱性硼化钒(VB2 )--空气电池如图所示,其中在VB2电极发生反应:VB2+16OH--11e-═+2B(OH)4-+4H2O该电池工作时,下列说法错误的是( )VO3-4发布:2024/4/20 14:35:0组卷:2071引用:34难度:0.5
872.一种高性能的碱性硼化钒(VB2 )--空气电池如图所示,其中在VB2电极发生反应:VB2+16OH--11e-═+2B(OH)4-+4H2O该电池工作时,下列说法错误的是( )VO3-4发布:2024/4/20 14:35:0组卷:2071引用:34难度:0.5873.化学在日常生活和生产中有着重要的应用.下列说法不正确的是( )
发布:2024/4/20 14:35:0组卷:30引用:5难度:0.9874.科学家研究出一种以天然气为燃料的“燃烧前捕获系统”,其简单流程如图1所示(部分条件及物质未标出)。

(1)已知:CH4、CO、H2的燃烧热分别为890.3kJ•mol-1、283.0kJ•mol-1、285.8kJ•mol-1,
则上述流程中第一步反应2CH4(g)+O2(g)=2CO(g)+4H2(g)ΔH=
(2)工业上可用H2和CO2制备甲醇,其反应为:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),某温度下,将1molCO2和3molH2充入体积不变的2L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下
①用H2表示前2h平均反应速率v(H2)=时间/h 1 2 3 4 5 6 P后/P前 0.90 0.85 0.83 0.81 0.80 0.80
②该温度下CO2的平衡转化率为
(3)在300℃、8MPa下,将二氧化碳和氢气按物质的量之比为1:3通入一密闭容器中发生(2)中反应,达到平衡时,测得二氧化碳的平衡转化率为50%,则该反应条件下的平衡常数KP=(用平衡分压代替平衡浓度计算,分压=总压X物质的量分数)。
(4)CO2经催化加氢可合成低碳烯烃:2CO2(g)+6H2(g)⇌C2H4(g)+4H2O(g)ΔH。
在0.1MPa时,按n(CO2):n(H2)=1:3投料,如图所示为不同温度(T)下,平衡时四种气态物质的物质的量(n)关系:
①该反应的ΔH0(填“>”、“=”或<)
②曲线c表示的物质为
③为提高CO2的平衡转化率,除改变温度外,还可采取的措施是发布:2024/4/20 14:35:0组卷:54引用:6难度:0.6875.可用于电动汽车的铝-空气燃料电池,通常以NaCl溶液或NaOH溶液为电解液,铝合金为负极,空气电极为正极.下列说法正确的是( )
发布:2024/4/20 14:35:0组卷:699引用:65难度:0.9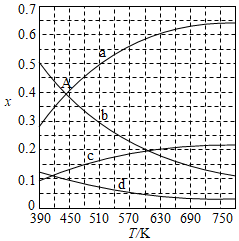 876.二氧化碳催化加氢合成乙烯是综合利用CO2的热点研究领域。回答下列问题:
876.二氧化碳催化加氢合成乙烯是综合利用CO2的热点研究领域。回答下列问题:
(1)CO2催化加氢生成乙烯和水的反应中,产物的物质的量之比n(C2H4):n(H2O)=。当反应达到平衡时,若增大压强,则n(C2H4)(填“变大”“变小”或“不变”)。
(2)理论计算表明。原料初始组成n(CO2):n(H2)=1:3,在体系压强为0.1MPa,反应达到平衡时,四种组分的物质的量分数x随温度T的变化如图所示。图中,表示C2H4、CO2变化的曲线分别是、。CO2催化加氢合成C2H4反应的△H0 (填“大于”或“小于”)。
(3)根据图中点A(440K,0.39),计算该温度时反应的平衡常数Kp=(MPa)-3(列出计算式。以分压表示,分压=总压×物质的量分数)。
(4)二氧化碳催化加氢合成乙烯反应往往伴随副反应,生成C3H6、C3H8、C4H8等低碳烃。一定温度和压强条件下,为了提高反应速率和乙烯选择性,应当。发布:2024/4/20 14:35:0组卷:1351引用:11难度:0.4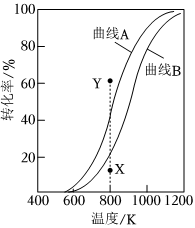 877.CH4与CO2重整生成H2和CO的过程中主要发生下列反应
877.CH4与CO2重整生成H2和CO的过程中主要发生下列反应
CH4(g)+CO2(g)═2H2(g)+2CO(g)ΔH=+247.1kJ•mol-1
H2(g)+CO2(g)═H2O(g)+CO(g)ΔH=+41.2kJ•mol-1
在恒压、反应物起始物质的量比n(CH4):n(CO2)=1:1 条件下,CH4和CO2的平衡转化率随温度变化的曲线如图所示。下列有关说法正确的是( )发布:2024/4/20 14:35:0组卷:320引用:14难度:0.5878.反应2A(g)+B(g)⇌xC(g)+2D(s),在一定条件下的2L容器中,1mol A与0.5mol B反应达到平衡时A为0.3mol/L,在1L容器中1mol A与0.5mol B在相同温度下反应达到平衡时A为0.5mol/L,则x值最合适为( )
发布:2024/4/20 14:35:0组卷:34引用:7难度:0.7879.如图是一个简易测量物质反应是吸热还是放热的实验装置,利用此装置可以很方便地测得某反应是放热反应还是吸热反应.请根据装置回答下列问题:
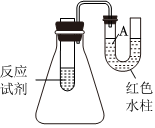
(1)将铝片加入小试管内,然后注入足量稀盐酸,有关反应的离子方程式是,试管中观察到的现象是.
(2)U形导管中液面A(填“上升”或“下降”),原因是,
说明此反应是(填“吸热”或“放热”)反应.发布:2024/4/20 14:35:0组卷:97引用:10难度:0.1880.25时,将不同浓度的二元弱酸H2A和NaOH溶液等体积混合(体积变化忽略不计),测得反应后溶液的pH如下表:下列判断不正确的是( )
实验编号 起始浓度/mol•L-1 反应后溶液的pH c(H2A) c(NaOH) ① X 0.10 9 ② 0.10 0.10 5 发布:2024/4/20 14:35:0组卷:47引用:6难度:0.7



