当前位置:
章节挑题
请展开查看知识点列表
>
更多>>
|
原创
 更新中
更新中
|
初升高衔接
知识精讲
搭配典例
精选练习
浏览次数:313
更新:2025年07月01日
|
 已完结
已完结
|
专题复习
温故知新
人教版(2019)
苏教版(2019)
浏览次数:277
更新:2025年06月26日
|
1.近来科学家研制了一种新型的乙醇电池(DEFC),它用磺酸类质子作溶剂,在200℃左右时供电,乙醇电池比甲醇电池效率高出32倍且更加安全.电池总反应式为C2H5OH+3O2═2CO2+3H2O,下列说法不正确的是( )
发布:2024/12/30 19:30:2组卷:53引用:10难度:0.72.反应N2(g)+3H2(g)⇌2NH3(g)△H<0,若在恒压绝热容器中发生,下列选项表明反应一定已达平衡状态的是( )
发布:2024/12/30 19:0:1组卷:257引用:34难度:0.53.研究CO2氧化C2H6制C2H4对资源综合利用有重要意义。
相关的主要化学反应有:
ⅠC2H6(g)⇌C2H4(g)+H2(g)ΔH1═136kJ•mol-1
ⅡC2H6(g)+CO2(g)⇌C2H4(g)+H2O(g)+CO(g)ΔH2═177kJ•mol-1
ⅢC2H6(g)+2CO2(g)⇌4CO(g)+3H2(g)ΔH3
ⅣCO2(g)+H2(g)⇌CO(g)+H2O(g)ΔH4═41kJ•mol-1
已知:298K时,相关物质的相对能量(如图1)。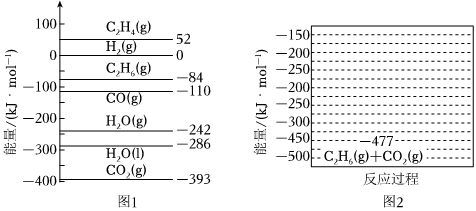
可根据相关物质的相对能量计算反应或变化的ΔH(ΔH随温度变化可忽略)。例如:H2O(g)═H2O(l)ΔH=-286kJ•mol-1-(-242kJ•mol-1)=-44kJ•mol-1。
请回答:
(1)①根据相关物质的相对能量计算ΔH3=kJ•mol-1。
②下列描述正确的是
A.升高温度反应Ⅰ的平衡常数增大
B.加压有利于反应Ⅰ、Ⅱ的平衡正向移动
C.反应Ⅲ有助于乙烷脱氢,有利于乙烯生成
D.恒温恒压下通水蒸气,反应Ⅳ的平衡逆向移动
③有研究表明,在催化剂存在下,反应Ⅱ分两步进行,过程如下:【C2H6(g)+CO2(g)】→【C2H4(g)+H2(g)+CO2(g)】→【C2H4(g)+CO(g)+H2O(g)】,且第二步速率较慢(反应活化能为210kJ•mol-1)。根据相关物质的相对能量,画出反应Ⅱ分两步进行的“能量-反应过程图”,起点从【C2H6(g)+CO2(g)】的能量-477kJ•mol-1,开始(如图2)。
(2)①CO2和C2H6按物质的量1:1投料,在923K和保持总压恒定的条件下,研究催化剂X对“CO2氧化C2H6制C2H4”的影响,所得实验数据如下表:
结合具体反应分析,在催化剂X作用下,CO2氧化C2H6的主要产物是催化剂 转化率C2H6/% 转化率CO2/% 产率C2H4/% 催化剂X 19.0 37.6 3.3 ,判断依据是。
②采用选择性膜技术(可选择性地让某气体通过而离开体系)可提高C2H4的选择性(生成C2H4的物质的量与消耗C2H6的物质的量之比)。在773K,乙烷平衡转化率为9.1%,保持温度和其他实验条件不变,采用选择性膜技术,乙烷转化率可提高到11.0%.结合具体反应说明乙烷转化率增大的原因是。发布:2024/12/30 13:30:2组卷:546引用:3难度:0.34.下列图示变化为吸热反应的是( )
发布:2024/12/14 8:0:21组卷:166引用:12难度:0.5 5.把镁条(去除氧化膜)投入到盛有盐酸的敞口容器中,产生H2的速率v与时间t的关系如图所示,其中影响AB段速率的主要因素是( )发布:2024/11/7 18:30:2组卷:129引用:12难度:0.9
5.把镁条(去除氧化膜)投入到盛有盐酸的敞口容器中,产生H2的速率v与时间t的关系如图所示,其中影响AB段速率的主要因素是( )发布:2024/11/7 18:30:2组卷:129引用:12难度:0.96.Zn-MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液。
(1)该电池的负极材料是。电池工作时,电子流向(填“正极”或“负极”)。
(2)若ZnCl2-NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是欲除去Cu2+,最好选用下列试剂中的(填字母)。
a.NaOH
b.Zn
c.Fe
d.NH3•H2O
(3)MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液。阴极的电极反应式是。若电解电路中通过2mol电子,MnO2的理论产量为g。
(4)将锌片和银片浸入稀硫酸中组成原电池,两电极间连接一个电流计。若该电池中两电极的总质量为60g,工作一段时间后,取出锌片和银片洗净干燥后称重,总质量为47g,试计算:
①产生氢气的体积(标准状况);
②通过导线的电荷量。(已知NA=6.02×1023mol-1,电子电荷量为1.60×10-19C)发布:2024/7/23 8:0:8组卷:1引用:1难度:0.57.下列说法不正确的是( )
①当碰撞的分子具有足够的能量和合适的取向时,才能发生化学反应
②发生有效碰撞的分子一定是活化分子
③活化分子间的碰撞一定是有效碰撞
④活化分子间每次碰撞都发生化学反应
⑤能发生有效碰撞的分子必须具有足够高的能量发布:2024/7/11 8:0:9组卷:114引用:4难度:0.68.用如图装置进行中和热的测定实验,分别取50mL0.55mol•L-1的NaOH溶液50mL0.25mol•L-1的稀硫酸进行实验。回答下列问题:
(1)近似认为0.55mol•L-1NaOH溶液和0.25mol•L-1硫酸溶液的密度都是1g•cm-3,中和后生成溶液的比热容c=4.18J•g-1•℃-1,通过以下数据计算中和热△H=( 结果保留至小数点后一位)。温度
实验次数起始温度t1/℃ 终止温度t2/℃ H2SO4 NaOH 平均值 1 26.2 26.0 26.1 29.5 2 27.0 27.4 27.2 32.3 3 25.9 25.9 25.9 29.2 4 26.4 26.2 26.3 29.8 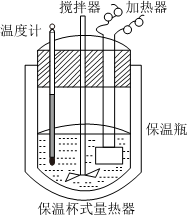 (2)中和反应的反应热测定实验中,下列说法错误的是 (填字母,下同)。
(2)中和反应的反应热测定实验中,下列说法错误的是 (填字母,下同)。
A.一组完整实验数据至少需要测温度三次
B.用保温杯是为了减少实验过程中热量散失
C.可用铜做的环形搅拌器代替玻璃搅拌器,因铜和硫酸不反应
D.在量取NaOH溶液和硫酸溶液体积时均仰视,测得中和反应的反应热数值将偏大
(3)进行中和反应的反应热测定的实验,测量结果偏高的原因可能是。
A.实验装置保温、隔热效果差
B.用温度计测定NaOH溶液起始温度后直接测定硫酸的温度
C.量取NaOH溶液的体积时仰视读数
D.分多次把NaOH溶液倒入盛有硫酸的小烧杯中发布:2024/7/11 8:0:9组卷:6引用:1难度:0.69.黑火药是中国古代的四大发明之一,其爆炸的热化学方程式为:
S(s)+2KNO3(s)+3C(s)═K2S(s)+N2(g)+3CO2(g)△H=“x”kJ•mol-1
已知碳的燃烧热△H1=“a”kJ•mol-1
S(s)+2K(s)═K2S(s)△H2=“b”kJ•mol-1
2K(s)+N2(g)+3O2(g)═2KNO3(s)△H3=“c”kJ•mol-1
则x为( )发布:2024/7/11 8:0:9组卷:296引用:11难度:0.710.已知物质A2和B2反应的热化学方程式如下(Q1、Q2、Q3均为正值):
A2(g)+B2(g)═2AB(l)△H=-Q1kJ•mol-1
A2(g)+B2(g)═2AB(g)△H=-Q2kJ•mol-1
A2(g)+B2(l)═2AB(g)△H=-Q3kJ•mol-1
下列判断正确的是( )发布:2024/7/11 8:0:9组卷:2引用:2难度:0.6



