当前位置:
试题详情
Zn-MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液。
(1)该电池的负极材料是 ZnZn。电池工作时,电子流向 正极正极(填“正极”或“负极”)。
(2)若ZnCl2-NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是 Zn+Cu2+=Zn2++Cu,形成原电池发生反应,加快反应速率Zn+Cu2+=Zn2++Cu,形成原电池发生反应,加快反应速率欲除去Cu2+,最好选用下列试剂中的 bb(填字母)。
a.NaOH
b.Zn
c.Fe
d.NH3•H2O
(3)MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液。阴极的电极反应式是 2H++2e-═H2↑2H++2e-═H2↑。若电解电路中通过2mol电子,MnO2的理论产量为 87g87gg。
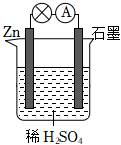
(4)将锌片和银片浸入稀硫酸中组成原电池,两电极间连接一个电流计。若该电池中两电极的总质量为60g,工作一段时间后,取出锌片和银片洗净干燥后称重,总质量为47g,试计算:
①产生氢气的体积(标准状况) 4.48L4.48L;
②通过导线的电荷量 3.8528×104C3.8528×104C。(已知NA=6.02×1023mol-1,电子电荷量为1.60×10-19C)
【考点】原电池与电解池的综合.
【答案】Zn;正极;Zn+Cu2+=Zn2++Cu,形成原电池发生反应,加快反应速率;b;2H++2e-═H2↑;87g;4.48L;3.8528×104C
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/7/23 8:0:8组卷:1引用:1难度:0.5