当前位置:
章节挑题
请展开查看知识点列表
>
更多>>
 已完结
已完结
|
热点预测
中考复习
热搜题专练
浏览次数:615
更新:2025年04月27日
|
 已完结
已完结
|
热点预测
高考复习
新题抢练
浏览次数:563
更新:2025年04月25日
|
481.下表为元素周期表的一部分,请参照元素①~⑨在表中的位置,回答下列问题:
(1)②和③的最高价含氧酸的酸性强弱关系是主族
周期
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
0一 ① 二 ② ③ ④ 三 ⑥ ⑦ ⑧ ⑤ ⑨ (用化学式填写)。
(2)元素⑥⑦⑨的简单离子的离子半径由大到小的顺序(用离子符号填写)。
(3)用电子式表示元素⑥与⑤形成化合物的过程。
(4)①、②、⑥的元素符号用X、Y、Z表示,它们所形成的化合物ZYX4的电子式为(用元素符号表示)。
(5)甲是元素①与④形成的化合物,分子中含有18个电子,则甲的结构式为。发布:2024/4/20 14:35:0组卷:14引用:2难度:0.6482.下列说法中正确的是( )
发布:2024/4/20 14:35:0组卷:27引用:1难度:0.5483.在下列变化中:①I2升华;②烧碱熔化;③NaCl溶于水;④HCl溶于水;⑤Na2O2溶于水。
(1)未破坏化学键的是。(填序号,下同)
(2)仅离子键被破坏的是。
(3)仅共价键被破坏的是。
(4)离子键和共价键同时被破坏的是。发布:2024/4/20 14:35:0组卷:30引用:1难度:0.7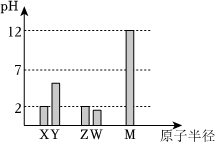 484.已知X、Y、Z、W、M均为短周期主族元素。25℃时,各元素最高价氧化物对应水化物溶液(浓度均为0.01mol/L)的pH和原子半径的关系如图所示。下列说法不正确的是( )发布:2024/4/20 14:35:0组卷:6引用:1难度:0.5
484.已知X、Y、Z、W、M均为短周期主族元素。25℃时,各元素最高价氧化物对应水化物溶液(浓度均为0.01mol/L)的pH和原子半径的关系如图所示。下列说法不正确的是( )发布:2024/4/20 14:35:0组卷:6引用:1难度:0.5485.(1)氯化钠的熔点(804℃)低于氟化钠的熔点(933℃)的主要原因是
。
(2)CaCl2O是离子化合物,各原子均满足8电子稳定结构,CaCl2O的电子式是。
(3)热胀冷缩是自然界的普遍现象,但当温度由0℃上升至4℃时,水的密度却增大,主要原因是。发布:2024/4/20 14:35:0组卷:47引用:2难度:0.7486.Q、R、X、Y、Z为前20号元素中的五种,Q的低价氧化物与X单质分子的电子总数相等,R与Q同族,X、Y与Z不同族,Y和Z的离子与Ar原子的电子结构相同且Y的原子序数小于Z.
(1)Q的最高价氧化物,其固态属于晶体,俗名叫;
(2)R的氢化物分子的空间构型是,属于分子(填“极性”或“非极性”);它与X形成的化合物可作为一种重要的陶瓷材料,其化学式是;
(3)X的常见氢化物的空间构型是;它的另一氢化物X2H4是一种火箭燃料的成分,其电子式是;
(4)Q分别与Y、Z形成的共价化合物的化学式是和;Q与Y形成的分子的电子式是,属于分子(填“极性”或“非极性”).发布:2024/4/20 14:35:0组卷:515引用:23难度:0.3487.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
发布:2024/4/20 14:35:0组卷:6引用:2难度:0.7488.下列分子中,各分子的空间构型和中心原子的杂化方式均正确的是( )
发布:2024/4/20 14:35:0组卷:154引用:6难度:0.9489.已知H-H键键能(断裂时吸收或生成时释放的能量)为436kJ•mol-1,H-N键键能为391kJ•mol-1,根据热化学方程式:N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ•mol-1.则N≡N键的键能是
.发布:2024/4/20 14:35:0组卷:42引用:2难度:0.1490.在1到20号元素中,已知五种元素的核电荷数的大小顺序为F>A>B>D>E;A、F具有相同的电子层数;B、F具有相同的最外层电子数;A与B形成离子化合物A2B,A2B中所有离子的电子数相同,其电子总数为30;D和E可形成4核10电子分子。
(1)写出D元素形成的单质的结构式;E、F和B三种元素形成的化合物属于(填晶体类型);写出B和E形成的化合物的化学式。
(2)在标准状况下,1克E的单质在足量的B的单质中完全反应,方程142.9kJ的热量,写出该反应的热化学方程式。
(3)元素Y的原子质子数比A多9,假如Y形成的强碱式量为M,把质量为mg的该强碱,在一定条件下,完全溶解在水中得到VmL饱和溶液,若此溶液的密度为ρg/cm3,则该溶液中OH-离子的物质的量浓度为。发布:2024/4/20 14:35:0组卷:19引用:2难度:0.7



