2023年河北省衡水中学高考化学第五次测评试卷
发布:2024/7/17 8:0:9
一、单项选择题(本题共14小题,每小题3分,共42分.每小题只有一个选项符合题目要求)
-
1.勤洗手是预防细菌和病毒感染简单而有效的方法。一种免洗洗手液成分为三氯羟基二苯醚乙醇、甘油等,下列有关此洗手液的说法错误的是( )
组卷:34引用:3难度:0.7 -
2.安全是顺利进行实验及避免伤害的保障。下列实验操作正确且不是从实验安全角度考虑的是( )
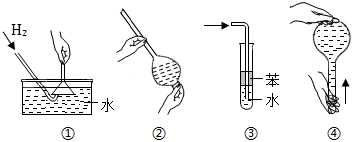 组卷:168引用:21难度:0.9
组卷:168引用:21难度:0.9 -
3.氮在自然界中的循环如图所示。NA为阿伏加德罗常数的值,下列说法错误的是( )
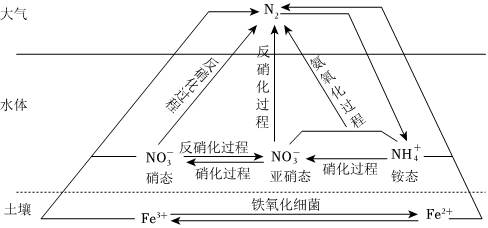 组卷:30引用:2难度:0.7
组卷:30引用:2难度:0.7 -
4.R、M、X、Y、Z为短周期元素,其原子的最外层电子数与原子半径的关系如图所示。下列说法正确的是( )
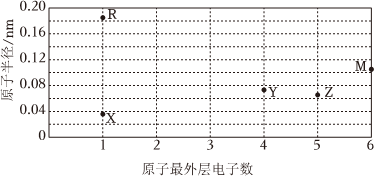 组卷:40引用:2难度:0.5
组卷:40引用:2难度:0.5 -
5.298K时,BaSO4与BaCO3在水中的沉淀溶解平衡曲线如图所示,下列说法错误的是( )
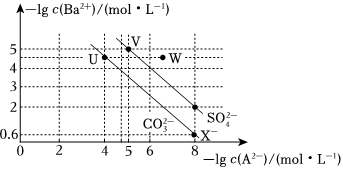
已知:101.4=25。组卷:115引用:4难度:0.6 -
6.已知反应:CH2=CHCH3(g)+Cl2(g)⇌CH2=CHCH2Cl(g)+HCl(g)。在一定压强下,按w=
向密闭容器中充入氯气与丙烯。图甲表示平衡时,丙烯的体积分数(φ)与温度(T)、w的关系,图乙表示正、逆反应的平衡常数(K)与温度(T)的关系。则下列说法中错误的是( )n(Cl2)n(CH2=CHCH3)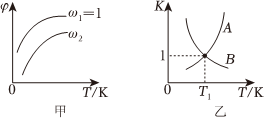 组卷:179引用:3难度:0.5
组卷:179引用:3难度:0.5
二、非选择题(本题共4小题,共58分)
-
17.亚硝酰硫酸(NOSO4H)在重氮化反应中可以代替亚硝酸钠.实验室用如图装置(部分夹持仪器略)制备少量亚硝酰硫酸,并测定产品纯度。
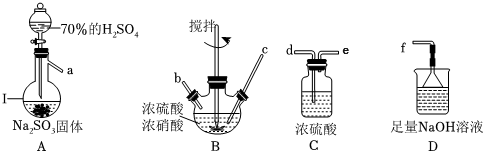
已知:i.亚硝酰硫酸是白色片状、多孔或粒状晶体,遇水分解为硫酸、硝酸和NO,溶于浓硫酸而不分解。
ii.实验室制备亚硝酰硫酸的原理为SO2+HNO3=SO3+HNO2,SO3+HNO2=NOSO4H。
回答下列问题:
(1)仪器Ⅰ的名称为,按照气流从左到右的顺序,上述仪器的连接顺序为(填仪器接口的字母,部分仪器可以重复使用)。
(2)C装置的作用为。
(3)反应需将温度控制在25~40℃,采用水浴加热的优点是,开始时反应缓慢,但某时刻反应速率明显加快,其原因可能是。
(4)测定亚硝酰硫酸的纯度。
步骤①:准确称取14.00g产品,在特定条件下配制成250mL溶液。
步骤②:取25.00mL①中溶液于250mL烧瓶中,加入60.00mL未知浓度KMnO4溶液(过量)和10.00mL25%H2SO4溶液,摇匀,发生反应:2KMnO4+5NOSO4H+2H2O=K2SO4+2MnSO4+5HNO3+2H2SO4。
步骤③:向②反应后溶液中加0.2500mol⋅L-1Na2C2O4标准溶液进行滴定,消耗Na2C2O4溶液20.00mL。
步骤④:把②中亚硝酰硫酸溶液换为蒸馏水(空白实验),重复上述步骤,消耗Na2C2O4溶液的体积为60.00mL。
滴定终点时的现象为,亚硝酰硫酸的纯度为%(精确到0.1)。组卷:36引用:1难度:0.6 -
18.分铜液净化渣主要含铜、碲(Te)、锑(Sb)、砷(As)等元素的化合物,一种回收工艺流程如图所示。
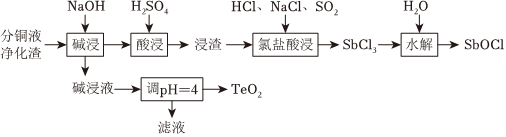
已知:①“碱浸”时,铜、锑转化为难溶氢氧化物或氧化物,碱浸液含有Na2TeO3、Na3AsO4。
②“酸浸”时,锑元素反应生成难溶的Sb2O(SO4)4浸渣。
③查阅资料得知:离子晶体的熔点一般较高,在600~2000℃,共价晶体具有较高的熔点,一般在1000℃以上。
回答下列问题:
(1)基态As的价层电子轨道表示式为。
(2)“碱浸”时,TeO2与NaOH反应的离子方程式为。
(3)向碱浸液中加盐酸调节pH=4,有TeO2析出,分离TeO2,滤液中As元素最主要的存在形式为(常温下,H3AsO4的各级电离常数:Ka1=6.3×10-3、Ka2=1.0×10-7、Ka3=3.2×10-12,填字母)。
A.H3AsO4
B.H2AsO-4
C.HAsO2-4
D.AsO3-4
(4)“氯盐酸浸”时,通入SO2的目的是。
(5)“水解”时,生成SbOCl的化学方程式为。
(6)TeO2可用作电子元件材料,熔点为733℃,其熔点远高于SO2的原因为。TeO2晶胞是长方体结构(如图所示),已知NA为阿伏加德罗常数的值,则该晶体的密度为g⋅cm-3(列出计算表达式)。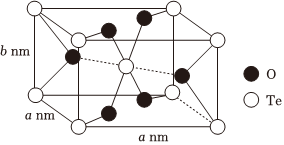 组卷:38引用:1难度:0.6
组卷:38引用:1难度:0.6


