2022-2023学年北京市八一学校高二(上)期中化学试卷
发布:2024/10/2 9:0:1
一、单选题(本题包括18小题,1-12题每小题2分,13-18题每小题2分,共42分)
-
1.下列铁制品防护的装置或方法中,不正确的是( )
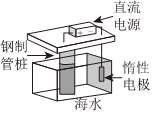
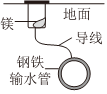

A B C D 组卷:6引用:1难度:0.5 -
2.25℃和1.01×105Pa时,2N2O5(g)═4NO2(g)+O2(g)ΔH=+56.76kJ/mol,该反应能自发进行的原因是( )
组卷:78引用:7难度:0.8 -
3.硫酸工业中的核心反应:2SO2(g)+O2(g)⇌2SO3(g)ΔH=-197kJ/mol,如果要提高SO2的平衡转化率,下列措施不可行的是( )
组卷:0引用:1难度:0.5 -
4.在恒容密闭容器中反应:2NO(g)+2CO(g)⇌N2(g)+2CO2(g) ΔH=-373.4kJ•mol-1达到平衡状态,以下说法不正确的是( )
组卷:2引用:1难度:0.7 -
5.在密闭容器中发生下列反应:aA(g)═cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是( )
组卷:65引用:15难度:0.9 -
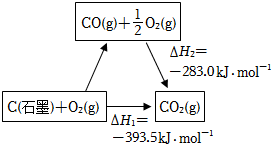 6.依据图示关系,下列说法不正确的是( )组卷:129引用:11难度:0.6
6.依据图示关系,下列说法不正确的是( )组卷:129引用:11难度:0.6 -
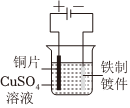
7.关于如图装置的说法正确的是( )
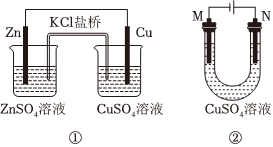 组卷:4引用:1难度:0.5
组卷:4引用:1难度:0.5
二、填空题(共58分)
-
22.氨在能源、化肥生产等领域有着非常重要的用途。
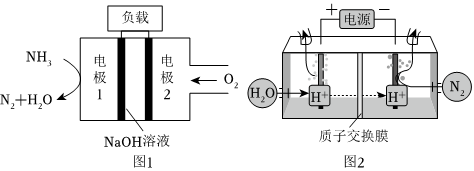
(1)25℃时,NH3和O2能反应生成NO和液态水,生成6mol水时放出1289kJ的热量,其热化学方程式是。
(2)与H2-O2燃料电池相比,氨易液化,运输和储存方便,安全性能更高。新型NH3-O2燃料电池原理如图1所示:
①电极1为(填“正极”或“负极”),电极2的反应式为。
②氨气也可以在纯氧中燃烧,此时化学能转化为热能。
已知:2H2(g)+O2(g)═2H2O(g)ΔH1
N2(g)+3H2(g)⇌2NH3(g)ΔH2
4NH3(g)+3O2(g)═2N2(g)+6H2O(g)ΔH3
ΔH1、ΔH2、ΔH3之间的关系式为:ΔH3=。
③与热能相比,电能具有更高的利用价值,燃料电池可将化学能直接转化为电能的原因是原电池可将氧化反应与还原反应进行,使得电子发生定向移动,形成电流。
(3)请结合下列数据分析,工业上选用氮气与氢气反应固氮,而没有选用氮气和氧气反应固氮的原因是。
(4)常温常压下电解法合成氨的原理如图2所示:序号 化学反应 K(298K)的数值 ① N2(g)+O2(g)⇌2NO(g) 5×10-31 ② N2(g)+3H2(g)⇌2NH3(g) 4.1×106
①阳极产生的气体是。
②阴极生成氨的电极反应式为。
③经检测在阴极表面发生了副反应,导致氨的产量降低。写出该副反应的电极反应式。组卷:2引用:1难度:0.4 -
23.为探究化学平衡移动原理与氧化还原反应规律的联系,某同学对Na2SO3溶液和铬(Ⅵ)盐溶液的反应规律进行研究,并进行如下实验:
已知:①Cr2(橙色)+H2O⇌2O2-7(黄色)+2H+CrO2-4
②铬(Ⅵ)盐即六价的铬盐,被还原生成Cr3+(绿色)
(1)进行实验ⅰ和ⅱ:
用离子方程式解释ⅰ中现象:序号 操作 现象 i 向2mLpH=2的0.05mol•L-1K2Cr2O7橙色溶液中滴加饱和Na2SO3溶液(pH约为9)3滴 溶液变绿色(含Cr3+) ii 向2mLpH=8的0.1mol•L-1K2CrO4黄色溶液中滴加饱和Na2SO3溶液3滴 溶液没有明显变化 。
(2)继续进行实验ⅲ:
为了说明产生上述现象的原因,补充实验:序号 操作 现象 ⅲ 向2mL饱和Na2SO3溶液中滴加pH=2的0.05mol•L-1K2Cr2O7橙色溶液3滴 溶液变黄色
向2mL蒸馏水中滴加pH=2的0.05mol•L-1K2Cr2O7橙色溶液3滴,溶液变成浅橙色。
①补充实验的目的是。
②用化学平衡移动原理解释ⅲ中现象:。
③根据实验ⅰ~ⅲ,可推测:Na2SO3溶液和铬(Ⅵ)盐溶液的反应与溶液酸碱性有关。
a.碱性条件下,Na2SO3溶液和铬(Ⅵ)盐溶液不发生氧化还原反应;
b.。
④向实验ⅲ所得黄色溶液中继续滴加硫酸,产生的现象证实了上述推测。该现象是。
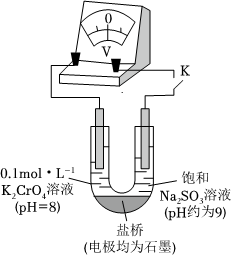
(3)为探究溶液酸性增强对Na2SO3溶液还原性或铬(Ⅵ)盐溶液氧化性的影响,该同学利用如图装置继续实验(已知电压大小反映了物质氧化还原性强弱的差异;物质氧化性与还原性强弱差异越大,电压越大)。
a.K闭合时,电压为x。
b.向U型管左侧溶液中滴加硫酸至pH=2后,电压增大了y。
c.继续向U型管右侧溶液中滴加硫酸后,无气体逸出,电压几乎不变。
①上述实验说明:。
②有同学认为该实验不够严谨,理由是:也会使电压增大于是补做了一个实验:U型管左管中盛放pH=8的0.1mol/LK2SO4溶液,右管盛放饱和Na2SO3溶液,闭合K记录电压;先向左管溶液中滴加硫酸至pH=2后,记录电压,测得电压增大了z,z<y证明实验结论不受影响。组卷:14引用:2难度:0.6


