氨在能源、化肥生产等领域有着非常重要的用途。
(1)25℃时,NH3和O2能反应生成NO和液态水,生成6mol水时放出1289kJ的热量,其热化学方程式是 4NH3(g)+5O2(g)催化剂△4NO(g)+6H2O(l)ΔH=-1289kJ/mol4NH3(g)+5O2(g)催化剂△4NO(g)+6H2O(l)ΔH=-1289kJ/mol。
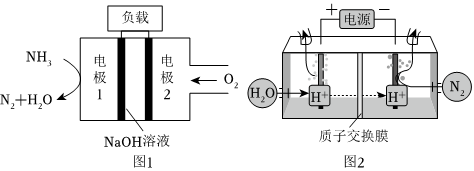
(2)与H2-O2燃料电池相比,氨易液化,运输和储存方便,安全性能更高。新型NH3-O2燃料电池原理如图1所示:
①电极1为 负极负极(填“正极”或“负极”),电极2的反应式为 O2+4e-+H2O=4OH-O2+4e-+H2O=4OH-。
②氨气也可以在纯氧中燃烧,此时化学能转化为热能。
已知:2H2(g)+O2(g)═2H2O(g)ΔH1
N2(g)+3H2(g)⇌2NH3(g)ΔH2
4NH3(g)+3O2(g)═2N2(g)+6H2O(g)ΔH3
ΔH1、ΔH2、ΔH3之间的关系式为:ΔH3=3ΔH1-2ΔH23ΔH1-2ΔH2。
③与热能相比,电能具有更高的利用价值,燃料电池可将化学能直接转化为电能的原因是原电池可将氧化反应与还原反应 分开分开进行,使得电子发生定向移动,形成电流。
(3)请结合下列数据分析,工业上选用氮气与氢气反应固氮,而没有选用氮气和氧气反应固氮的原因是 氮气与氢气的反应限度远大于氨气与氧气的反应限度氮气与氢气的反应限度远大于氨气与氧气的反应限度。
催化剂
△
催化剂
△
| 序号 | 化学反应 | K(298K)的数值 |
| ① | N2(g)+O2(g)⇌2NO(g) | 5×10-31 |
| ② | N2(g)+3H2(g)⇌2NH3(g) | 4.1×106 |
①阳极产生的气体是
O2
O2
。②阴极生成氨的电极反应式为
N2+6e-+6H+=2NH3
N2+6e-+6H+=2NH3
。③经检测在阴极表面发生了副反应,导致氨的产量降低。写出该副反应的电极反应式
2H++2e-=H2↑
2H++2e-=H2↑
。【答案】4NH3(g)+5O2(g)4NO(g)+6H2O(l)ΔH=-1289kJ/mol;负极;O2+4e-+H2O=4OH-;3ΔH1-2ΔH2;分开;氮气与氢气的反应限度远大于氨气与氧气的反应限度;O2;N2+6e-+6H+=2NH3;2H++2e-=H2↑
催化剂
△
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/10/2 9:0:1组卷:2引用:1难度:0.4
相似题
-
1.肼(N2H4)可作为发射火箭的燃料。已知1g液态肼(N2H4)气体在空气中燃烧生成氮气和水蒸气,放出16.7kJ的热量,该反应的热化学方程式是( )
发布:2024/12/30 3:0:4组卷:121引用:9难度:0.6 -
2.氢在地球上主要以化合态的形式存在,是宇宙中分布最广泛的物质,它构成了宇宙质量的75%,属于二次能源.工业上生产氢的方式很多,常见的有水电解制氢,煤炭气化制氢,重油及天然气水蒸气催化制氢等.氢气是一种理想的绿色能源,如图1为氢能产生和利用的途径:
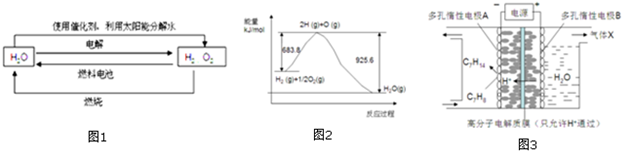
(1)图1的四个过程中能量转化形式有
A.2种 B.3种 C.4种 D.4种以上
(2)电解过程要消耗大量的电能,而使用微生物作催化剂在阳光下也能分解水.
2H2O(1)2H2(g)+O2(g)△H 1 2H2O(1)通电2H2(g)+O2(g)△H2光照催化剂
以上反应的△H1△H2(选填“<”、“>”或“=”)
(3)已知H2O(l)→H2O(g)△H=+44kJ.mol-1,依据图2能量变化写出氢气燃烧生产液态水的热化学方程式
(4)氢能利用需要选择合适的储氢材料.
①NaBH4是一种重要的储氢载体,能与水反应生成NaBO2,且反应前后B的化合价不变,该反应的化学方程式为
②镧镍合金在一定条件下可吸收氢气生产氢化物:LaNi3(s)+3H2(g)═LaNi3H6(s)△H<0,欲使LaNi3H6(s)释放出气态氢,根据平衡移动的原理,可改变的条件之一是
③一定条件下,如图3所示装置可实现有机物的电化学储氢,使C7H8转化为C7H14,则电解过程中产生的气体X 为,电极A上发生的电极反应式为.发布:2024/12/17 8:0:2组卷:38引用:1难度:0.5 -
3.在298K、1.01×105Pa下,将0.5mol CO2通入750mL 1mol•L-1NaOH溶液中充分反应,测得反应放出xkJ的热量。已知在该条件下,1mol CO2通入1L 2mol•L-1NaOH溶液中充分反应放出ykJ的热量,则CO2与NaOH溶液反应生成NaHCO3的热化学方程式正确的是( )
发布:2024/12/30 4:0:1组卷:143引用:5难度:0.7


