为探究化学平衡移动原理与氧化还原反应规律的联系,某同学对Na2SO3溶液和铬(Ⅵ)盐溶液的反应规律进行研究,并进行如下实验: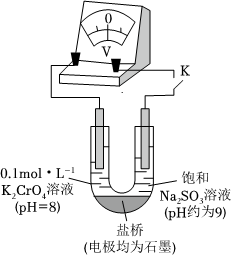
已知:①Cr2O2-7(橙色)+H2O⇌2CrO2-4(黄色)+2H+
②铬(Ⅵ)盐即六价的铬盐,被还原生成Cr3+(绿色)
(1)进行实验ⅰ和ⅱ:
O
2
-
7
C
r
O
2
-
4
| 序号 | 操作 | 现象 |
| i | 向2mLpH=2的0.05mol•L-1K2Cr2O7橙色溶液中滴加饱和Na2SO3溶液(pH约为9)3滴 | 溶液变绿色(含Cr3+) |
| ii | 向2mLpH=8的0.1mol•L-1K2CrO4黄色溶液中滴加饱和Na2SO3溶液3滴 | 溶液没有明显变化 |
Cr2+3+8H+═2Cr3++3+4H2O
O
2
-
7
SO
2
-
3
SO
2
-
4
Cr2+3+8H+═2Cr3++3+4H2O
。O
2
-
7
SO
2
-
3
SO
2
-
4
(2)继续进行实验ⅲ:
| 序号 | 操作 | 现象 |
| ⅲ | 向2mL饱和Na2SO3溶液中滴加pH=2的0.05mol•L-1K2Cr2O7橙色溶液3滴 | 溶液变黄色 |
向2mL蒸馏水中滴加pH=2的0.05mol•L-1K2Cr2O7橙色溶液3滴,溶液变成浅橙色。
①补充实验的目的是
排除水的稀释对溶液颜色变化造成的影响
排除水的稀释对溶液颜色变化造成的影响
。②用化学平衡移动原理解释ⅲ中现象:
Cr2(橙色)+H2O⇌2(黄色)+2H+,溶液中大量的(或OH-)与H+结合导致溶液中c(H+)下降,平衡正向移动,溶液颜色变黄
O
2
-
7
C
r
O
2
-
4
SO
2
-
3
Cr2(橙色)+H2O⇌2(黄色)+2H+,溶液中大量的(或OH-)与H+结合导致溶液中c(H+)下降,平衡正向移动,溶液颜色变黄
。O
2
-
7
C
r
O
2
-
4
SO
2
-
3
③根据实验ⅰ~ⅲ,可推测:Na2SO3溶液和铬(Ⅵ)盐溶液的反应与溶液酸碱性有关。
a.碱性条件下,Na2SO3溶液和铬(Ⅵ)盐溶液不发生氧化还原反应;
b.
酸性条件下,Na2SO3溶液和铬(VI)盐溶液发生氧化还原反应,生成Cr3+
酸性条件下,Na2SO3溶液和铬(VI)盐溶液发生氧化还原反应,生成Cr3+
。④向实验ⅲ所得黄色溶液中继续滴加硫酸,产生的现象证实了上述推测。该现象是
溶液变绿
溶液变绿
。(3)为探究溶液酸性增强对Na2SO3溶液还原性或铬(Ⅵ)盐溶液氧化性的影响,该同学利用如图装置继续实验(已知电压大小反映了物质氧化还原性强弱的差异;物质氧化性与还原性强弱差异越大,电压越大)。
a.K闭合时,电压为x。
b.向U型管左侧溶液中滴加硫酸至pH=2后,电压增大了y。
c.继续向U型管右侧溶液中滴加硫酸后,无气体逸出,电压几乎不变。
①上述实验说明:
溶液酸性增强,铬(VI)盐溶液的氧化性增强,Na2SO3溶液的还原性几乎没有变化
溶液酸性增强,铬(VI)盐溶液的氧化性增强,Na2SO3溶液的还原性几乎没有变化
。②有同学认为该实验不够严谨,理由是:
随溶液酸性增强,溶液中O2的氧化性增强
随溶液酸性增强,溶液中O2的氧化性增强
也会使电压增大于是补做了一个实验:U型管左管中盛放pH=8的0.1mol/LK2SO4溶液,右管盛放饱和Na2SO3溶液,闭合K记录电压;先向左管溶液中滴加硫酸至pH=2后,记录电压,测得电压增大了z,z<y证明实验结论不受影响。【答案】Cr2+3+8H+═2Cr3++3+4H2O;排除水的稀释对溶液颜色变化造成的影响;Cr2(橙色)+H2O⇌2(黄色)+2H+,溶液中大量的(或OH-)与H+结合导致溶液中c(H+)下降,平衡正向移动,溶液颜色变黄;酸性条件下,Na2SO3溶液和铬(VI)盐溶液发生氧化还原反应,生成Cr3+;溶液变绿;溶液酸性增强,铬(VI)盐溶液的氧化性增强,Na2SO3溶液的还原性几乎没有变化;随溶液酸性增强,溶液中O2的氧化性增强
O
2
-
7
SO
2
-
3
SO
2
-
4
O
2
-
7
C
r
O
2
-
4
SO
2
-
3
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/10/2 9:0:1组卷:14引用:2难度:0.6
相似题
-
1.如图是在实验室进行二氧化硫制备与性质实验的组合装置,部分固定装置未画出。
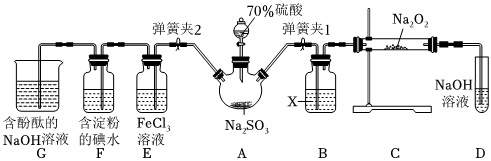
(1)在组装好装置后,若要检验A~D装置的气密性,其操作是首先,然后往D中装入水,然后微热A,观察到D中有气泡冒出,移开酒精灯或松开双手,D中导管有水柱形成且高度保持不变,说明装置气密性良好。
(2)装置D中盛放NaOH溶液的作用是。
(3)关闭弹簧夹1后,打开弹簧夹2,残余气体进入E、F、G中,能说明I-还原性弱于SO2的现象为;发生反应的离子方程式是。
(4)为了验证E中SO2与FeCl3发生了氧化还原反应,设计了如下实验:取E中的溶液,往溶液中加入用稀硝酸酸化的BaCl2溶液,产生白色沉淀,说明SO2与FeCl3发生了氧化还原反应。上述方案是否合理?(填“合理”或“不合理”),原因是。
(5)实验过程中G中含酚酞的NaOH溶液逐渐褪色,此实验证明SO2具有漂白性还是其溶于水显酸性?请设计实验验证:。发布:2024/12/30 14:0:1组卷:29引用:2难度:0.5 -
2.某化学兴趣小组为探究铜跟浓硫酸的反应,用图装置进行有关实验.请回答下列问题:
(1)装置A中发生的化学反应的化学方程式为.
(2)装置B 的作用是贮存多余的气体,B中广口瓶内应盛放的液体是(填序号)
①水 ②酸性KMnO4 ③Na2CO3溶液 ④饱和的NaHSO3溶液
(3)装置C和D 中产生的现象相同,但原因却不同.用离子方程式和必要的文字解释C中溶液褪色的原因
(4)装置D中试管口塞一团棉花,棉花中应浸有一种液体,这种液体是.
(5)实验完毕,待A中烧瓶内液体冷却后,过滤,向滤液中加入少量的蒸馏水稀释,溶液为蓝色.为了证明蓝色只与Cu2+有关,而与其它离子无关,某同学设计了下列实验,其中对实验目的没有意义的是(填序号)
①观察稀H2SO4 溶液呈无色 ②观察CuSO4 粉末呈白色 ③稀释CuSO4溶液,溶液蓝色变浅 ④往CuSO4溶液中加入足量NaOH溶液,生成蓝色沉淀,过滤,滤液呈无色⑤往CuSO4溶液中加入足量BaCl2的溶液,生成白色沉淀,过滤,滤液仍显蓝色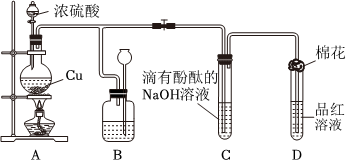 发布:2024/12/30 14:30:1组卷:13引用:2难度:0.7
发布:2024/12/30 14:30:1组卷:13引用:2难度:0.7 -
 3.某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验。
3.某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验。
Ⅰ.(1)将钠、钾、镁、铝各1mol分别投入到足量的同浓度的盐酸中,试预测实验结果:与盐酸反应最剧烈,与盐酸反应产生的气体最多。(填元素符号)
(2)向Na2S溶液中通入氯气出现黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为:。
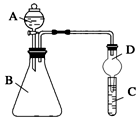
Ⅱ.利用如图装置可验证同主族元素非金属性的变化规律
(1)仪器A的名称为。
(2)实验室中现有药品:①稀盐酸 ②稀硝酸 ③Na2SiO3溶液 ④Na2CO3固体,请选择合适药品设计实验验证 N、C、Si的非金属性的变化规律;装置A、B中所装药品分别为、。(填序号)但有同学认为该装置有缺陷,如何改进?。发布:2024/12/30 14:30:1组卷:19引用:2难度:0.5


