人教版(2019)选择性必修1《第1章 化学反应的热效应》2023年单元测试卷(10)
发布:2024/8/16 8:0:1
一、选择题
-
1.室温下将1mol的CuSO4•5H2O(s)溶于水会使溶液温度降低,热效应为△H1,将1mol的CuSO4(s)溶于水会使溶液温度升高,热效应为△H2;CuSO4•5H2O受热分解的化学方程式为:CuSO4•5H2O(s)═CuSO4(s)+5H2O(l),热效应为△H3.则下列判断正确的是( )
组卷:1137引用:71难度:0.7 -
2.已知:H2O(g)═H2O(l)△H1
C6H12O6(g)═C6H12O6(s)△H2
C6H12O6(s)+6O2(g)═6H2O(g)+6CO2(g)△H3
C6H12O6(g)+6O2(g)═6H2O(l)+6CO2(g)△H4
下列说法正确的是( )组卷:260引用:6难度:0.7 -
3.下列关于反应热和焓变的说法正确的是( )
组卷:45引用:5难度:0.9 -
4.下列图示变化为吸热反应的是( )
组卷:86引用:11难度:0.8 -
5.已知化学反应 S(1)+O2(g)═SO2(g),通常情况下,燃烧1moLS液体生成SO2气体放出 293.23kJ 的热量。分析下列说法中正确的是( )
组卷:62引用:4难度:0.7 -
6.下列热化学方程式的书写正确的是(已知:氢气、一氧化碳、乙醇、甲烷的标准燃烧热分别为:-285.8 kJ•mol-1、-283.0 kJ•mol-1、-1366.8 kJ•mol-1、-890.3 kJ•mol-1)( )
组卷:54引用:5难度:0.8 -
7.反应A+B→C(△H<0)分两步进行:①A+B=X(△H>0),②X→C(△H<0)。下列图象能正确表示该反应过程中的能量变化的是( )
组卷:48引用:5难度:0.7 -
8.已知:S(g)+O2(g)═SO2(g);△H1
S(s)+O2(g)═SO2(g);△H2
2H2S(g)+O2(g)═2S(s)+2H2O(l);△H3
2H2S(g)+3O2(g)═2SO2(g)+2H2O(l);△H4
SO2(g)+2H2S(g)═3S(s)+2H2O(l);△H5
下列关于上述反应焓变的判断不正确的是( )组卷:176引用:10难度:0.7
四、解答题
-
24.根据有关要求回答问题:
(1)如图1是1molNO2(g)和1molCO(g)反应生成CO2和NO过程中能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是,ΔH的变化是(填“增大”、“减小”、“不变”)。请写出NO2和CO反应的热化学方程式:。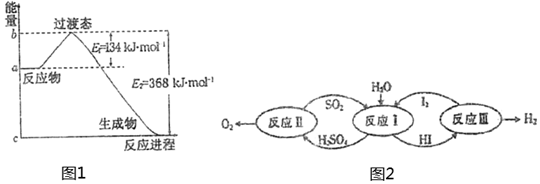
(2)以太阳能为热源,热化学硫碘循环分解水是一种高效、无污染的制氢方法。其反应过程如图2所示。反应Ⅱ包含两步反应:
第一步:H2SO4 (1)═SO3(g)+H2O(g) ΔH1=+177kJ/mol
第二步:2SO3(g)═2SO2(g)+O2(g) ΔH2=+196kJ/mol
①写出第一步反应自发进行的条件是:。
②写出反应Ⅱ的热化学方程式:。组卷:12引用:2难度:0.4 -
 25.氯及其化合物在生活和生产中应用广泛。
25.氯及其化合物在生活和生产中应用广泛。
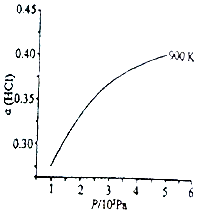
(1)已知:900K时,4HCl(g)+O2(g)⇌2Cl2(g)+2H2O(g),反应自发。
①该反应是反应(填“放热”或“吸热”)。
②900K时,体积比为4:1的HCl和O2在恒温恒容的密闭容器中发生反应,HCl的平衡转化率α(HCl)随压强(P)变化曲线如图。保持其他条件不变,升温到T K (假定反应历程不变),请画出压强在1.5×105~4.5×105Pa范围内,HCl的平衡转化率α(HCl)随压强(P)变化曲线示意图。
(2)已知:
Cl2(g)+2NaOH(aq)═NaCl(aq)+NaClO(aq)+H2O(l)△H1=-102kJ/mol
3Cl2(g)+6NaOH(aq)═5NaCl(aq)+NaClO3(aq)+3H2O(l)△H2=-422kJ/mol
①写出在溶液中NaClO分解生成NaClO3的热化学方程式:。
②用过量的冷NaOH溶液吸收氯气,制得NaClO溶液(不含NaClO3),此时ClO-的浓度为c0mol/L;加热时NaClO转化为NaClO3,测得t时刻溶液中ClO-浓度为c1mol/L,写出该时刻溶液中Cl-浓度的表达式;c(Cl-)=mol/L(用c0、c1表示)
③有研究表明,生成NaClO3的反应分两步进行:
I.2ClO-═ClO2-+Cl-
II.ClO2-+ClO-═ClO3-+Cl-
常温下,反应II能快速进行,但氯气与NaOH溶液反应很难得到NaClO3,试用碰撞理论解释其原因。
(3)电解NaClO3水溶液可制备NaClO4.在电解过程中由于阴极上吸附氢气,会使电解电压升高,电解效率下降。为抑制氢气的产生,可选择合适的物质(不引入杂质),写出该电解的总化学方程式。组卷:13引用:2难度:0.6


