 氯及其化合物在生活和生产中应用广泛。
氯及其化合物在生活和生产中应用广泛。
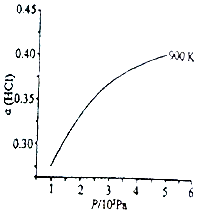
(1)已知:900K时,4HCl(g)+O2(g)⇌2Cl2(g)+2H2O(g),反应自发。
①该反应是放热放热反应(填“放热”或“吸热”)。
②900K时,体积比为4:1的HCl和O2在恒温恒容的密闭容器中发生反应,HCl的平衡转化率α(HCl)随压强(P)变化曲线如图。保持其他条件不变,升温到T K (假定反应历程不变),请画出压强在1.5×105~4.5×105Pa范围内,HCl的平衡转化率α(HCl)随压强(P)变化曲线示意图。
(2)已知:
Cl2(g)+2NaOH(aq)═NaCl(aq)+NaClO(aq)+H2O(l)△H1=-102kJ/mol
3Cl2(g)+6NaOH(aq)═5NaCl(aq)+NaClO3(aq)+3H2O(l)△H2=-422kJ/mol
①写出在溶液中NaClO分解生成NaClO3的热化学方程式:3NaClO(aq)=2NaCl(aq)+NaClO3(aq)△H=-116KJ/mol3NaClO(aq)=2NaCl(aq)+NaClO3(aq)△H=-116KJ/mol。
②用过量的冷NaOH溶液吸收氯气,制得NaClO溶液(不含NaClO3),此时ClO-的浓度为c0mol/L;加热时NaClO转化为NaClO3,测得t时刻溶液中ClO-浓度为c1mol/L,写出该时刻溶液中Cl-浓度的表达式;c(Cl-)=5c0-2c135c0-2c13mol/L(用c0、c1表示)
③有研究表明,生成NaClO3的反应分两步进行:
I.2ClO-═ClO2-+Cl-
II.ClO2-+ClO-═ClO3-+Cl-
常温下,反应II能快速进行,但氯气与NaOH溶液反应很难得到NaClO3,试用碰撞理论解释其原因反应Ⅰ的活化能高,活化分子百分数低,不利于ClO-向ClO3-转化反应Ⅰ的活化能高,活化分子百分数低,不利于ClO-向ClO3-转化。
(3)电解NaClO3水溶液可制备NaClO4.在电解过程中由于阴极上吸附氢气,会使电解电压升高,电解效率下降。为抑制氢气的产生,可选择合适的物质(不引入杂质),写出该电解的总化学方程式2NaClO3+O2 通电 2NaClO42NaClO3+O2 通电 2NaClO4。
5
c
0
-
2
c
1
3
5
c
0
-
2
c
1
3
通电
通电
【答案】放热;3NaClO(aq)=2NaCl(aq)+NaClO3(aq)△H=-116KJ/mol;;反应Ⅰ的活化能高,活化分子百分数低,不利于ClO-向ClO3-转化;2NaClO3+O2 2NaClO4
5
c
0
-
2
c
1
3
通电
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/8/16 8:0:1组卷:13引用:2难度:0.6
相似题
-
1.如图是一些常见含氯产品,根据情况回答下列问题。

(1)下列有关氯单质和氯水的说法正确的是(填序号)。
①液氯是纯净物,氯水是混合物
②氯气可使湿润的红色布条褪色,所以氯气具有漂白性
③过量的铁在少量的氯气中燃烧生成FeCl2
④新制氯水可使蓝色石蕊试纸先变红后褪色
⑤新制氯水放置数天后酸性将减弱
(2)漂白粉常用于对环境和饮用水进行杀菌、消毒,以抑制大规模传染病爆发。写出漂白粉在空气中杀菌消毒的原理。(用化学方程式表示)
(3)据报道,有人在清洗卫生间时,因混合使用“洁厕灵”(主要成分为稀盐酸)与“84”消毒液(有效成分NaClO),而发生氯气中毒事件,请从氧化还原的角度分析原因 (用离子方程式表示)。
(4)某“84”消毒液部分标签如图所示:
①计算该“84”消毒液的物质的量浓度净含量:500mL 密度:1.19gcm-3
主要成分:25% NaClO
注意喜项:密封保存,易吸收空气中的CO2变质mol•L-1。(保留小数点后一位)
②某实验需用250mL上述消毒液,现用NaClO固体配制。在配制过程中,除需要烧杯、托盘天平处还必需的仪器有(写三种),下列操作可能使配制溶液浓度偏低的是。
A.移液时,未洗涤烧杯内壁和玻璃棒
B.溶解后未经冷却就移液
C.移液时,有少量液体溅出
D.定容时,俯视刻度线
E.容量瓶用蒸馏水洗净后,没烘干就直接使用
F.定容时,仰视刻度线发布:2025/1/15 8:0:2组卷:35引用:1难度:0.7 -
2.下列有关盐酸的说法中正确的是( )
发布:2025/1/1 8:0:2组卷:4引用:0难度:0.9 -
3.关于盐酸的叙述正确的是( )
发布:2025/1/1 8:0:2组卷:20引用:7难度:0.9


