2022-2023学年上海市大同中学高一(下)期末化学试卷
发布:2024/9/6 3:0:8
解答题
-
1.德米特里•伊万诺维奇•门捷列夫是著名的俄国化学家,他对化学的发展作出了卓越的贡献。请回答下列问题:
(1)门捷列夫的突出贡献是。
A.提出原子学说
B.发现元素周期律
C.提出分子学说
D.发现氧气
(2)某元素的原子L层电子数比K层电子数多3个,与该元素同一主族的短周期元素是。
(3)C、O、Na的原子半径从大到小的顺序为。
(4)请你根据原子结构示意图,分别指出这些原子所含的质子数、元素周期表中的位置。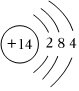
质子数:;
周期表中位置:。
(5)请将短周期元素或其化合物填入下列表格:
①金属性最强的元素是(填元素符号);
②形成化合物种类最多的元素是(填元素符号);
③第三周期中,简单气态氢化物热稳定性最好的是(填写分子式)。
(6)元素周期表是指导我们系统学习化学的重要工具。如图是元素周期表的一部分。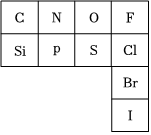
①从原子结构角度分析,C、N、O、F四种元素处于同一行,是由于它们的相同。
②氮元素的最低化合价为,其气态氢化物的电子式为。在表中所列元素的最高价氧化物对应水化物中酸性最强的是(写化学式)。
③Cl的非金属性(填“强于”、“弱于”或“等于”)Br的非金属性。海水提溴的原理是用氯气将溴离子氧化,请写出氯气与溴化钠溶液反应的化学方程式,并标出电子转移的方向和数目。
(7)元素周期表中每种元素的具体信息如图示例,从中你可以获取硫元素的哪些信息,请简要阐述(任写一个)。 组卷:49引用:1难度:0.7
组卷:49引用:1难度:0.7
解答题
-
4.碳中和指二氧化碳或温室气体净排放为零。即通过碳汇、碳捕集、利用与封存等方式抵消全部的二氧化碳或温室气体排放量,实现正负抵消,达到相对“零排放”。请回答下列问题:
(1)化学与生活、社会密切相关。下列说法错误的是。
A.利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境
B.凡含有食品添加剂的食物对人体健康均有害,不可食用
C.为防止电池中的重金属等污染土壤和水体,应积极开发废电池的综合利用技术
D.减少使用不可降解的塑料袋,是为了防止白色污染
(2)下列反应中,既属于复分解反应同时又是吸热反应的是。
A.Ba(OH)2⋅8H2O与NH4Cl反应
B.镁与稀硫酸反应
C.氢气还原氧化铜
D.酸碱中和反应
(3)下列有关化学反应与能量变化的说法正确的是。
A.同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的ΔH不同
B.相同条件下,氢气和氧气反应生成液态水的焓变大于生成等量的气态水
C.已知:H+(aq)+OH-(aq)═H2O(l)ΔH=-57.3kJ⋅mol-1,则H2SO4(aq)+Ba(OH)2(aq)═BaSO4(s)+2H2O(l)ΔH=2×(-57.3)kJ⋅mol-1
D.16g甲烷在空气中燃烧生成CO2和液态水放热890.3kJ,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)ΔH=-890.3kJ⋅mol-1
(4)反应A+B═CΔH<0分两步进行①A+B═XΔH>0;②X═CΔH<0。下列示意图中,能正确表示总反应过程中能量变化的是。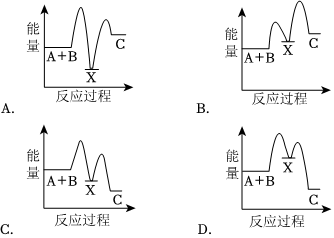
(5)SiH4是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2和液态H2O。已知室温下2gSiH4自燃放出热量89.2kJ。请写出SiH4自燃的热化学方程式。
(6)“氢能”将是实现碳中和的理想能源,利用硫-碘热循环法制取氢也是化学家常用的一种方法,其过程分三步进行:
(a)SO2+I2+2H2O═2HI+H2SO4
(b)2HIH2+I2△
(c)2H2SO42SO2↑+O2↑+2H2O△
写出硫-碘热循环法制取氢气的总化学方程式,并对该法制氢的优劣和前景进行分析。组卷:42引用:1难度:0.5
解答题
-
5.钠元素以盐的形式广泛的分布于陆地和海洋中,钠也是人体肌肉组织和神经组织中的重要成分之一。钠的化合物是重要的化工原料。请回答下列问题:
(1)按图所示方法来收集产生的气体,需将钠包好,再放入水中。取相同质量的钠按下列两种情况:
①用铝箔包住钠、②用铜箔包住钠。则收集产生的气体在相同条件下体积的关系是。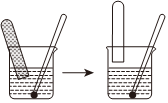
A.二者收集气体一样多
B.①收集气体体积较大
C.②收集气体体积较大
D.无法确定
(2)下列各组中的两物质作用时,反应条件或反应物用量的改变,对生成物没有影响的是。
A.Na2O和CO2
B.Na和O2
C.NaOH与CO2
D.碳与O2
(3)下列说法正确的是。
A.切开的金属Na暴露在空气中,光亮的表面逐渐变暗,发生的反应为2Na+O2═Na2O2
B.Na与稀硫酸反应的离子方程式为Na+2H+═Na++H2↑
C.4.6gNa与O2完全反应,生成7g产物时失去电子的物质的量为0.2mol
D.将少量Na投入到稀的CuSO4溶液中,会析出红色金属
某同学为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如图Ⅰ~Ⅳ所示。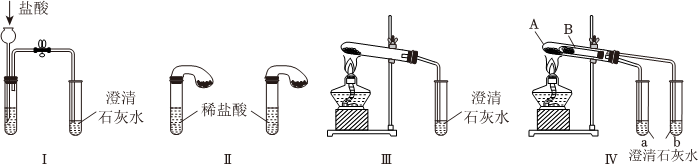
(4)实验Ⅰ、Ⅱ(盐酸足量且固体质量相同)中能够达到实验目的的是(填装置序号)。
(5)实验Ⅲ、Ⅳ均能鉴别这两种物质,写出所发生的共同反应的化学方程式:、。
(6)与实验Ⅲ相比,实验Ⅳ的优点是。
A.Ⅳ比Ⅲ复杂
B.Ⅳ比Ⅲ安全
C.Ⅳ比Ⅲ操作简便
D.Ⅳ可以做到用一套装置同时进行两个对比实验,而Ⅲ不行
(7)若用实验Ⅳ验证碳酸钠和碳酸氢钠的稳定性,则试管B中装入的固体最好是。
Na2O2是中学化学常用的强氧化剂,除了能与CO2、H2O反应外,还可与其他还原剂如H2、C发生反应,某化学课外兴趣小组为探究Na2O2与H2的反应情况,设计了如图所示装置进行有关实验。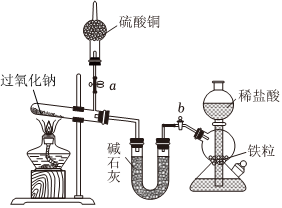
(8)该装置中,碱石灰的作用是;实验开始时,先打开a、b产生氢气,一段时间后,再点燃酒精灯加热,目的是。
(9)实际实验过程中观察到Na2O2熔化后,很快变成白色粉末,但干燥管内硫酸铜并未变成蓝色。则Na2O2与H2反应的化学方程式为。
(10)出于实验安全考虑,实验结束时。
A.应先关闭活塞b,再移去酒精灯
B.应先移去酒精灯,再关闭活塞b
C.A、B均可以组卷:52引用:1难度:0.5


