2022-2023学年江苏省无锡市高二(下)期末化学试卷
发布:2024/6/27 8:0:9
一、单项选择题:共14题,每题3分,共42分。每题只有一个选项最符合题意
-
1.下列说法正确的是( )
组卷:11引用:1难度:0.7 -
2.“神舟十三号”乘组航天员在空间站进行了三次“天宫授课”。以下实验均在太空失重环境下进行,下列说法错误的是( )
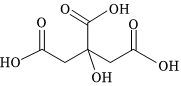
组卷:30引用:1难度:0.7 -
3.氢氧燃料电池是使用在航天领域常见的燃料电池,其反应原理,如图所示。下列说法正确的是( )
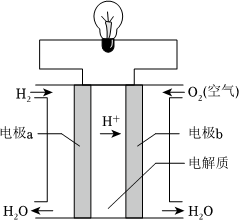
组卷:59引用:1难度:0.7 -
4.在给定条件下,下列选项所示的物质间转化能实现的是( )
组卷:34引用:1难度:0.6 -
5.下列关于物质的性质与用途具有对应关系的是( )
组卷:9引用:1难度:0.7 -
6.对于反应4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g) ΔH=-904kJ⋅mol-1,下列说法正确的是( )
组卷:81引用:1难度:0.5
二、非选择题:共4题,共58分。
-
17.ClO2是一种安全稳定、高效低毒的广谱型消毒剂,它易溶于水、难溶于有机溶剂,高浓度的ClO2气体易爆炸。常见制备ClO2的方法如下:
Ⅰ.利用NaClO2与纯净的Cl2反应可制得ClO2和NaCl,实验装置如图-1所示(夹持装置略)。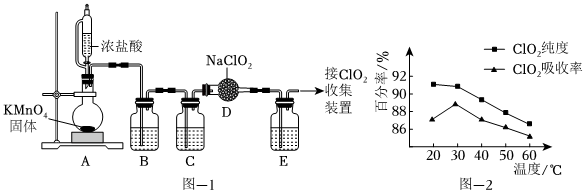
(1)装置B中试剂为。
(2)装置E中所盛试剂是CCl4,其作用为。
Ⅱ.草酸(H2C2O4)、氯酸钾和适当浓度的H2SO4溶液反应制取ClO2,反应中有CO2气体生成。
(3)该方法制备ClO2的优点是。
Ⅱ.以黄铁矿(FeS2)、氯酸钠和硫酸溶液混合反应制备ClO2,再用水吸收获得ClO2溶液。在ClO2的制备和吸收过程中均需要控制适宜的温度,如图-2所示为温度对ClO2纯度、吸收率的影响。
(4)已知:黄铁矿中的硫元素在酸性条件下被氧化成ClO-3,写出该法制备ClO2气体的离子方程式:SO2-4,由图可知,反应时采取的适宜措施是。
(5)某校化学学习小组拟以“×100%”作为衡量ClO2产率的指标。取NaClO3样品质量6.000g,通过反应和吸收可得400.00mLClO2溶液,取出20.00mL,加入37.00mL0.5000mol⋅L-1(NH4)2Fe(SO4)2溶液充分反应,过量Fe2+再用0.05000mol⋅L-1K2Cr2O7标准溶液滴定至终点,消耗20.00mL。反应原理如下(未配平):m(ClO2)m(NaClO3)
H++ClO2+Fe2+→Cl-+Fe3++H2O;H++Fe2++Cr2→Cr3++Fe3++H2O。试计算ClO2的产率O2-7(写出计算过程)。组卷:32引用:2难度:0.5 -
18.氨氮废水可通过沉淀或氧化处理,使水中氨氮达到国家规定的排放标准后才可以排放。已知水溶液中氨氮的存在形式主要由pH决定。当pH<9时,
是主要存在形式;当pH>9时,NH3是主要存在形式。NH+4
Ⅰ.沉淀法
向酸性废水中加入一定比例的MgCl2和Na2HPO4,将氨氮转化为NH4MgPO4⋅6H2O沉淀除去。已知25℃时磷酸电离平衡常数:Ka1=7.5×10-3、Ka2=6.2×10-8、Ka3=2.2×10-13。
(1)写出生成NH4MgPO4⋅6H2O沉淀的离子方程式。
(2)Na2HPO4溶液中:c()PO3-4c(H2)(填“>”、“<”或“=”)。PO-4
Ⅱ.氧化法
臭氧是一种相对安全的氧化剂,已被广泛应用于水处理中。已知臭氧很不稳定,在常温常压下即可分解为O2,在水中比在空气中更易分解。利用臭氧处理氨氮废水,实验跟踪监测O3氧化氨氮情况如图-1所示,反应条件:温度10℃,初始pH不同的50mg⋅L-1NH4Cl溶液(模拟氨氮废水)各250mL,4.56mg⋅L-1O3,接触时间60min。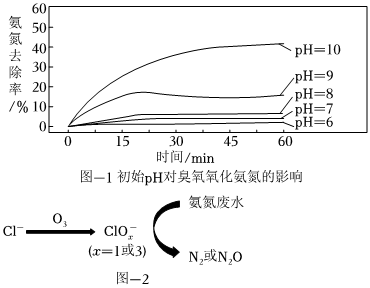
(3)pH>9,相同时间内氨氮去除率显著增大的可能原因是。
(4)若温度升高,相同时间内氨氮去除率降低,可能原因是。
(5)在弱酸性环境下,当废水中含有大量Cl-时,O3氧化氨氮废水的过程如图-2所示,该过程可描述为。组卷:50引用:2难度:0.7


