氨氮废水可通过沉淀或氧化处理,使水中氨氮达到国家规定的排放标准后才可以排放。已知水溶液中氨氮的存在形式主要由pH决定。当pH<9时,NH+4是主要存在形式;当pH>9时,NH3是主要存在形式。
Ⅰ.沉淀法
向酸性废水中加入一定比例的MgCl2和Na2HPO4,将氨氮转化为NH4MgPO4⋅6H2O沉淀除去。已知25℃时磷酸电离平衡常数:Ka1=7.5×10-3、Ka2=6.2×10-8、Ka3=2.2×10-13。
(1)写出生成NH4MgPO4⋅6H2O沉淀的离子方程式 NH+4+Mg2++H2PO-4+6H2O=NH4MgPO4•6H2O↓+H+NH+4+Mg2++H2PO-4+6H2O=NH4MgPO4•6H2O↓+H+。
(2)Na2HPO4溶液中:c(PO3-4) <<c(H2PO-4)(填“>”、“<”或“=”)。
Ⅱ.氧化法
臭氧是一种相对安全的氧化剂,已被广泛应用于水处理中。已知臭氧很不稳定,在常温常压下即可分解为O2,在水中比在空气中更易分解。利用臭氧处理氨氮废水,实验跟踪监测O3氧化氨氮情况如图-1所示,反应条件:温度10℃,初始pH不同的50mg⋅L-1NH4Cl溶液(模拟氨氮废水)各250mL,4.56mg⋅L-1O3,接触时间60min。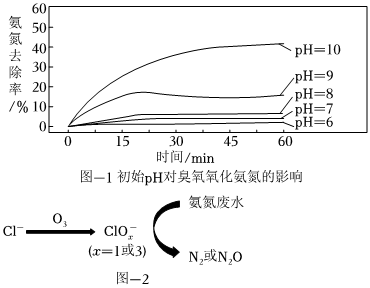
(3)pH>9,相同时间内氨氮去除率显著增大的可能原因是 pH>9时,氨氮主要存在形式为NH3,臭氧氧化NH3的速度大于氧化NH+4的速率(或碱性条件下,O3氧化能力增强,更易氧化NH3,提高了氨氮去除率)pH>9时,氨氮主要存在形式为NH3,臭氧氧化NH3的速度大于氧化NH+4的速率(或碱性条件下,O3氧化能力增强,更易氧化NH3,提高了氨氮去除率)。
(4)若温度升高,相同时间内氨氮去除率降低,可能原因是 温度升高,O3分解速率加快,且O3在溶液中的溶解度降低,导致溶液中O3浓度下降温度升高,O3分解速率加快,且O3在溶液中的溶解度降低,导致溶液中O3浓度下降。
(5)在弱酸性环境下,当废水中含有大量Cl-时,O3氧化氨氮废水的过程如图-2所示,该过程可描述为 弱酸性环境下,氨氮主要存在形式为NH+4,大量的Cl-与O3反应生成ClO-x(x=1或3),ClO-x(x=1或3)将NH+4氧化为N2或N2O弱酸性环境下,氨氮主要存在形式为NH+4,大量的Cl-与O3反应生成ClO-x(x=1或3),ClO-x(x=1或3)将NH+4氧化为N2或N2O。
NH
+
4
NH
+
4
PO
-
4
NH
+
4
PO
-
4
PO
3
-
4
PO
-
4
NH
+
4
NH
+
4
NH
+
4
C
l
O
-
x
C
l
O
-
x
NH
+
4
NH
+
4
C
l
O
-
x
C
l
O
-
x
NH
+
4
【答案】+Mg2++H2+6H2O=NH4MgPO4•6H2O↓+H+;<;pH>9时,氨氮主要存在形式为NH3,臭氧氧化NH3的速度大于氧化的速率(或碱性条件下,O3氧化能力增强,更易氧化NH3,提高了氨氮去除率);温度升高,O3分解速率加快,且O3在溶液中的溶解度降低,导致溶液中O3浓度下降;弱酸性环境下,氨氮主要存在形式为,大量的Cl-与O3反应生成(x=1或3),(x=1或3)将氧化为N2或N2O
NH
+
4
PO
-
4
NH
+
4
NH
+
4
C
l
O
-
x
C
l
O
-
x
NH
+
4
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/6/26 8:0:9组卷:49引用:2难度:0.7


