鲁科版(2019)选择性必修1《1.4 金属的腐蚀与防护》2023年同步练习卷(9)
发布:2024/8/17 6:0:3
一、选择题
-
1.下列说法正确的是( )
组卷:34引用:9难度:0.7 -
2.一定条件下,碳钢腐蚀与溶液pH的关系如下表,下列说法不正确的是( )
pH 2 4 6 6.5 8 13.5 14 腐蚀快慢 较快 慢 较快 主要产物 Fe2+ Fe3O4 Fe2O3 FeO2- 组卷:73引用:8难度:0.7 -
3.如图是金属牺牲阳极的阴极保护法的实验装置,有关说法正确的是( )
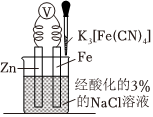 组卷:68引用:12难度:0.7
组卷:68引用:12难度:0.7 -
4.下列关于金属腐蚀的说法正确的是( )
组卷:34引用:4难度:0.8 -
5.下列文献记载内容涉及非氧化还原反应的是( )
组卷:13引用:3难度:0.8
五、解答题
-
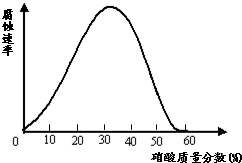 14.一些较活泼的金属在某些特定的介质环境中,会变为惰性状态,这是由于金属表面上覆盖了一层氧化膜.铁在不同浓度的硝酸中溶解与钝化情况如图如示.试探究下列问题:
14.一些较活泼的金属在某些特定的介质环境中,会变为惰性状态,这是由于金属表面上覆盖了一层氧化膜.铁在不同浓度的硝酸中溶解与钝化情况如图如示.试探究下列问题:
(1)现有一枚光亮的铁钉,欲使其表面形成钝化层,应将其放入浓度大于的硝酸中一段时间;证明其表面已形成一层致密的钝化层的简单实验是:.
(2)下列有关说法不正确的是(选填序号).
A.铜难溶于冷的浓硫酸,是因为铜在浓硫酸中发生钝化
B.铜片和铝片用导线连接后插入冷的浓硝酸中,电流一定总是由铜电极沿导线流入铝极
C.铁在硝酸溶液中的腐蚀速率与硝酸浓度一定呈正比
D.可用冷的浓硝酸除去铝制容器内的水垢
(3)发蓝液是由NaNO3、NaNO2及NaOH配成的,在加热条件下,通过三步反应使铁表面生成一层致密的Fe3O4:3Fe+NaNO2+5NaOH3Na2FeO2+H2O+NH3↑…①;△
8Fe+3NaNO3+5NaOH+2H2O4Na2Fe2O4+3NH3↑…②;△
以及第三步生成四氧化三铁.请补充第三步反应的方程式并配平:.
(4)为了使铝表面形成较厚的氧化膜,工业上常用电解硫酸溶液的方法,在阳极上生成氧化铝,写出此时阳极的电极反应:.组卷:26引用:2难度:0.5 -
 15.原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的项重大贡献。
15.原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的项重大贡献。
(1)某课外实验小组欲探究铝和铜的金属性(原子失电子能力)强弱,同学们提出了如下实验方案:
A.比较铝和铜的硬度和熔点
B.比较二者在稀硫酸中的表现
C.用铝片、铜片、硫酸铝溶液硫酸铜溶液,比较二者的活动性
D.分别做铝片、铜片与NaOH溶液反应的实验
E.将铝片、铜片用导线连接后共同投入稀盐酸中接入电流计,观察电流方向
上述方案中能达到实验目的的是。
(2)现有如下两个反应:A.NaOH+HCl=NaCl+H2O B.Zn+H2SO4=ZnSO4+H2↑
上述反应中能设计成原电池的是(填字母代号),作负极的物质发生了反应(填“氧化”或“还原”)。
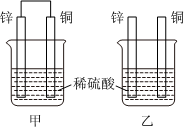
(3)将纯锌片和纯铜片按如图所示方式插入100 ml相同浓度的稀硫酸一段时间,回答下列问题:
①下列说法正确的是(填字母代号)。
A.甲、乙均为化学能转变为电能的装置 B.乙中铜片上没有明显变化
C.甲中铜片质量减少、乙中锌片质量减少 D.两烧杯中溶液的pH均增大
②在相同时间内,两烧杯中产生气泡的速度:甲乙(填“>”、“<”或“=”)。原因是。
③当甲中产生1.12 L(标准状况)气体时,将锌、铜片取出,再将烧杯中的溶液稀释至1 L,测得溶液中c(H+)=0.1 mol/L(设反应前后溶液体积不变)。试确定原稀硫酸的物质的量浓度为。组卷:13引用:2难度:0.7


