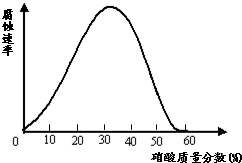
 一些较活泼的金属在某些特定的介质环境中,会变为惰性状态,这是由于金属表面上覆盖了一层氧化膜.铁在不同浓度的硝酸中溶解与钝化情况如图如示.试探究下列问题:
一些较活泼的金属在某些特定的介质环境中,会变为惰性状态,这是由于金属表面上覆盖了一层氧化膜.铁在不同浓度的硝酸中溶解与钝化情况如图如示.试探究下列问题:
(1)现有一枚光亮的铁钉,欲使其表面形成钝化层,应将其放入浓度大于57%57%的硝酸中一段时间;证明其表面已形成一层致密的钝化层的简单实验是:取硝酸浸泡后的铁钉放入CuSO4(稀硝酸)溶液中,铁钉表面没有红色的物质(气泡)析出取硝酸浸泡后的铁钉放入CuSO4(稀硝酸)溶液中,铁钉表面没有红色的物质(气泡)析出.
(2)下列有关说法不正确的是ABCABC(选填序号).
A.铜难溶于冷的浓硫酸,是因为铜在浓硫酸中发生钝化
B.铜片和铝片用导线连接后插入冷的浓硝酸中,电流一定总是由铜电极沿导线流入铝极
C.铁在硝酸溶液中的腐蚀速率与硝酸浓度一定呈正比
D.可用冷的浓硝酸除去铝制容器内的水垢
(3)发蓝液是由NaNO3、NaNO2及NaOH配成的,在加热条件下,通过三步反应使铁表面生成一层致密的Fe3O4:3Fe+NaNO2+5NaOH △ 3Na2FeO2+H2O+NH3↑…①;
8Fe+3NaNO3+5NaOH+2H2O △ 4Na2Fe2O4+3NH3↑…②;
以及第三步生成四氧化三铁.请补充第三步反应的方程式并配平:Na2FeO2+Na2Fe2O4+2H2O=Fe3O4↓+4NaOHNa2FeO2+Na2Fe2O4+2H2O=Fe3O4↓+4NaOH.
(4)为了使铝表面形成较厚的氧化膜,工业上常用电解硫酸溶液的方法,在阳极上生成氧化铝,写出此时阳极的电极反应:3H2O+2Al-6e-=Al2O3+6H+3H2O+2Al-6e-=Al2O3+6H+.
△
△
【答案】57%;取硝酸浸泡后的铁钉放入CuSO4(稀硝酸)溶液中,铁钉表面没有红色的物质(气泡)析出;ABC;Na2FeO2+Na2Fe2O4+2H2O=Fe3O4↓+4NaOH;3H2O+2Al-6e-=Al2O3+6H+
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/8/17 6:0:3组卷:26引用:2难度:0.5


