2022-2023学年北京市东直门中学高二(上)期中化学试卷
发布:2024/9/20 1:0:9
一、选择题(共54分)
-
1.中华民族的发明创造为人类文明进步做出了巨大贡献,下列过程主要是利用化学反应中能量变化的是( )
A B C D 
神十一载人飞船发射
粮食酿醋
湿法炼铜
打磨磁石制司南组卷:4引用:6难度:0.8 -
2.下列做法的目的与改变化学反应速率无关的是( )
组卷:37引用:5难度:0.5 -
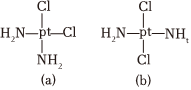 3.科学研究发现铂的两种化合物(短线表示化学键)有不同的特性,其中a具有抗癌作用,而b没有;则下列正确的说法是( )组卷:29引用:4难度:0.5
3.科学研究发现铂的两种化合物(短线表示化学键)有不同的特性,其中a具有抗癌作用,而b没有;则下列正确的说法是( )组卷:29引用:4难度:0.5 -
4.可逆反应2HI(g)⇌H2(g)+I2(g)在体积固定的密闭容器中,下列说法不能说明反应达到化学平衡状态的是( )
组卷:37引用:4难度:0.7 -
5.一定量的铁粉和水蒸气在一个容积可变的密闭容器中进行反应:3Fe(s)+4H2O(g)
Fe3O4(s)+4H2(g)。下列条件能使该反应的化学反应速率增大的是( )高温组卷:142引用:7难度:0.5 -
6.工业上处理含CO、SO2烟道气的一种方法是将其在催化剂作用下转化为S和CO2。
已知:2CO(g)+O2(g)═2CO2(g)ΔH=-566kJ/mol
S(s)+O2(g)═SO2(g)ΔH=-296kJ/mol
则该条件下2CO(g)+SO2(g)═S(s)+2CO2(g)的ΔH等于( )组卷:280引用:16难度:0.8 -
7.2mol NH3和3mol O2在2L密闭容器中发生反应4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g),2min后达到平衡,生成1.5mol NO.下列有关说法正确的是( )
组卷:28引用:7难度:0.7 -
8.已知:①2H2(g)+O2(g)═2H2O(g) ΔH=-483.6kJ•mol-1
②H2(g)+S(g)═H2S(g) ΔH=-20.1kJ•mol-1
下列判断正确的是( )组卷:5引用:2难度:0.5 -
9.汽车尾气处理时存在反应:NO2(g)+CO(g)⇌NO(g)+CO2(g),该反应过程及能量变化如图所示。下列说法正确的是( )
 组卷:17引用:2难度:0.5
组卷:17引用:2难度:0.5
二、非选择题(共46分)
-
27.实验小组探究酸对Fe3++3SCN-⇌Fe(SCN)3平衡的影响。将0.005mol•L-1FeCl3溶液(接近无色)和0.01mol•L-1KSCN溶液等体积混合,得到红色溶液。
已知:FeCl3溶液呈酸性的原因是Fe3+水解:Fe3++3H2O⇌Fe(OH)3+3H+。
(1)甲同学认加入酸后,会使Fe3++3SCN⇌Fe(SCN)3体系中增大,导致该平衡正向移动,溶液颜色加深。
【设计并实施实验】
取两等份红色溶液,进行如下操作并记录现象。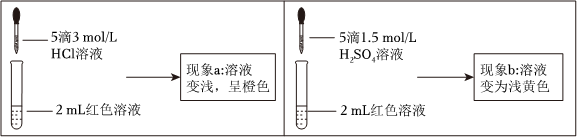
[查阅资料]
Fe3+和Cl-、均能发生络合反应(配位平衡):SO2-4
Fe3++4Cl-⇌[FeCl4]-(黄色);
Fe3++2⇌[Fe(SO4)2]-(无色)。SO2-4
实验Ⅰ.探究现象a中溶液颜色变化的原因
(2)实验①的目的是编号 操作 现象 ① 向2mL红色溶液中滴加5滴水 溶液颜色无明显变化 ② 向2mL红色溶液中滴加5滴3mol•L-1KCl溶液 溶液颜色变浅,呈橙色 。
(3)根据实验①和实验②的结果,从平衡移动角度解释现象a。
实验Ⅱ.探究现象b中溶液呈浅黄色的原因
(4)结合实验③可推测现象b中使溶液呈浅黄色的微粒可能有两种,分别是编号 操作 现象 ③ 取1mL0.0025mol•L-1Fe2(SO4)3溶液(无色)。加入1mL0.01mol•L-1KSCN溶液,再加入5滴1.5mol•L-1H2SO4溶液 溶液先变红,加硫酸后变为浅黄色 ④ 取1mL0.005mol•L-1FeCl3溶液, 。
(5)乙同学进一步补充了实验④,确证了现象b中使溶液呈浅黄色的微粒只是(4)中的一种,请将实验④的操作及现象补充完整:、。组卷:25引用:2难度:0.6 -
28.氨在国民经济中占有重要地位。
(1)合成氨工业中,合成塔中每产生2molNH3,放出92.2kJ热量。
①工业合成氨的热化学方程式是。
②若起始时向容器内放入2molN2和6molH2,达平衡时放出的热量为Q,则Q(填“>”“<”或“=”)184.4kJ。
③已知(图1),1molN-H键断裂吸收的能量等于kJ。
④理论上,为了增大平衡时H2的转化率,可采取的措施是(填序号)。
a.增大压强
b.使用合适的催化剂
c.升高温度
d.及时分离出产物中的NH3
(2)原料气H2可通过反应CH4(g)+H2O(g)⇌CO(g)+3H2(g)获取,已知该反应中,当初始混合气中的恒定时,温度、压强对平衡混合气中CH4含量的影响如图2所示。图中两条曲线表示的压强的关系是:p1n(H2O)n(CH4)p2(填“>”“=”或“<”)。
(3)原料气H2还可通过反应CO(g)+H2O(g)⇌CO2(g)+H2(g)获取。
①T℃时,向容积固定为5L的容器中充入1mol水蒸气和1molCO,反应达平衡后,测得CO的浓度为0.08mol•L-1,则该温度下反应的平衡常数K为。
②保持温度仍为T℃,改变水蒸气和CO的初始物质的量之比,充入容器进行反应,下列描述能够说明体系处于平衡状态的是(填序号)。
a.混合气体的平均相对分子质量不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成amolCO2的同时消耗amolH2
d.混合气中n(CO):n(H2O):n(CO2):n(H2)=1:16:6:6
(4)工业上以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为2NH3(g)+CO2(g)⇌CO(NH2)2(1)+H2O(1),该反应的平衡常数和温度关系如表:
①焓变△H(填“>”“<”或“=”)T/℃ 165 175 185 195 K 111.9 74.1 50.6 34.8 0。
②在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)=x,图3是氨碳比(x)与CO2平衡转化率(α%)的关系。图中的B点处,NH3的平衡转化率为n(NH3)n(CO2)。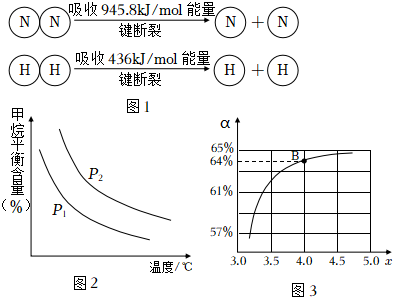 组卷:20引用:2难度:0.5
组卷:20引用:2难度:0.5


