2023-2024学年北京161中高二(上)期中化学练习试卷
发布:2024/10/13 0:0:1
一、选择题:本大题共14道小题,每小题3分,共42分.
-
1.下列设备工作时,将化学能转化为热能的是( )
A B C D 



燃气灶 铅蓄电池 太阳能热水器 风力发电 组卷:29引用:3难度:0.8 -
2.2022年3月神舟十三号航天员在中国空间站进行了“天宫课堂”授课活动。其中太空“冰雪实验”演示了过饱和醋酸钠溶液的结晶现象。下列说法不正确的是( )
组卷:10引用:1难度:0.8 -
3.下列措施不能加快Zn与1mol/LH2SO4反应产生H2的速率的是( )
组卷:145引用:5难度:0.7 -
4.常温下,下列溶液中,水电离出的c(H+)=1×10-2mol•L-1的是( )
组卷:87引用:4难度:0.7 -
5.下列仪器中,不属于酸碱中和滴定中常用仪器的是( )




A.分液漏斗 B.酸式滴定管 C.碱式滴定管 D.锥形瓶 组卷:15引用:2难度:0.7 -
6.体积恒定的密闭容器中发生反应2NO(g)+2CO(g)⇌N2(g)+2CO2(g)ΔH<0,其他条件不变时,下列说法正确的是( )
组卷:123引用:10难度:0.5
二、填空题:本大题共5小题,共58分.
-
 18.科研人员用以下方法测定高炉渣中金属Fe的含量。
18.科研人员用以下方法测定高炉渣中金属Fe的含量。
i.配制金属Fe浸取液。
ii.取mg粉碎后的高炉渣,加入足量金属Fe浸取液,室温下浸取1h。
iii.过滤,将滤液及洗涤液全部转移至盛有过量H2O2溶液的烧杯中,加入盐酸、稀硫酸充分反应。
iv.将反应后的溶液煮沸至冒大气泡并继续微沸10min。
v.冷却,用浓度为cmol•L-1的抗坏血酸(C6H8O6)标准溶液滴定,消耗抗坏血酸标准溶液VmL[已知:C6H8O6(抗坏血酸)+2Fe3+=C6H6O6(脱氢抗坏血酸)+2Fe2++2H+]。
(1)金属Fe浸取液配制方法:取一定量亚硫酸钠和邻菲罗啉(用于抑制Fe2+的水解)溶于水后,加入乙酸调节pH约为4,再加入一定量乙酸-乙酸铵溶液(pH=4.5),配成所需溶液(在此pH条件下,高炉渣中其他成分不溶解)。
①Fe2+水解的方程式为。
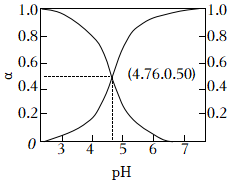
②常温下,改变乙酸溶液的pH,溶液中CH3COOH、CH3COO-的物质的量分数a(X)随pH的变化如右图所示,下列说法正确的是(填字母序号)。
已知:α(X)=n(X)n(CH3COOH)+n(CH3COO-)
a.常温下,乙酸的电离常数Ka(CH3COOH)=10-4.76
b.pH=4时,c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-)
c.pH=4.5的乙酸-乙酸铵溶液中,c(CH3COO-)+c(OH-)-c(H+)+c(NH4+)
d.向乙酸-乙酸铵溶液中加入少量酸时,溶液中的CH3COO-结合H+,使溶液中的c(H+)变化不大,溶液的pH变化不大
(2)步骤iii中加入过量H2O2溶液,可除去过量的SO32-,另一主要作用是(用离子方程式表示)。
(3)该高炉渣中金属Fe的质量分数ω(Fe)=(用有关字母的代数式表示)。
(4)若未进行步骤iv,直接用抗坏血酸标准溶液滴定,则会使高炉渣中金属Fe的质量分数ω(Fe)
(填“偏大”、“偏小”或“无影响”),理由是。组卷:35引用:4难度:0.5 -
19.实验小组制备硫代硫酸钠(Na2S2O3)并探究其性质。
资料:
ⅰ.S2+2H+═S↓+SO2↑+H2O。O2-3
ⅱ.Fe3++3S2⇌Fe(S2O3)33-(紫黑色)。O2-3
ⅲ.Ag2S2O3是难溶于水、可溶于Na2S2O3溶液的白色固体。
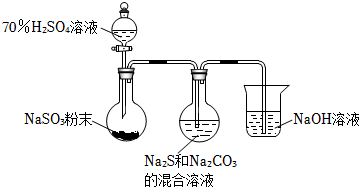
(1)实验室可利用反应:2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2制备Na2S2O3,装置如图。
①用化学用语解释Na2S和Na2CO3的混合溶液呈碱性的原因:S2-+H2O⇌HS-+OH-、。
②为了保证Na2S2O3的产量,实验中通入的SO2不能过量。要控制SO2的生成速率,可以采取的措施有:。(写出一条)
(2)探究Na2S2O3溶液与不同金属的硫酸盐溶液间反应的多样性。
①Ⅰ中产生白色沉淀的离子方程式为实
验试剂 现象 试管 滴管 
2mL 0.1mol/L Na2S2O3溶液 Ag2SO4溶液(浓度约为0.03mol/L) Ⅰ.局部生成白色沉淀,振荡后沉淀溶解,得到无色溶液 0.03mol/L Al2(SO4)3溶液 Ⅱ.一段时间后,生成沉淀 0.03mol/L Fe2(SO4)3溶液 Ⅲ.混合后溶液先变成紫黑色,30s时溶液几乎变为无色 。
②经检验,现象Ⅱ中的沉淀有Al(OH)3和S,用平衡移动原理解释Ⅱ中的现象:。
③经检验,现象Ⅲ中的无色溶液中含有Fe2+。从化学反应速率和限度的角度解释Ⅲ中Fe3+与S2反应的实验现象:O2-3。
以上实验说明:Na2S2O3溶液与金属阳离子反应的多样性和阳离子的性质有关。组卷:46引用:10难度:0.5


