2021-2022学年广东省茂名五中高二(上)期中化学试卷
发布:2024/9/20 3:0:8
一、选择题:本题共16小题,共44分。第1~10小题,每小题2分;第11~16小题,每小题2分。在每小题给出的四个选项中,只有一项是符合题目要求的。
-
1.N2和H2在催化剂表面合成氨的微观历程及能量变化的示意图如下,用
 、
、 、
、 分别表示N2、H2、NH3,已知:N2(g)+3H2(g)⇌2NH3(g),该反应属于放热反应。下列说法正确的是( )
分别表示N2、H2、NH3,已知:N2(g)+3H2(g)⇌2NH3(g),该反应属于放热反应。下列说法正确的是( )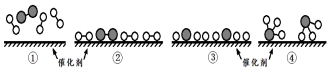 组卷:8引用:2难度:0.5
组卷:8引用:2难度:0.5 -
2.下列热化学方程式书写正确的是( )
组卷:124引用:7难度:0.8 -
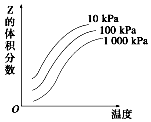 3.如图是温度和压强对X+Y⇌2Z反应影响的示意图。图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是( )组卷:274引用:8难度:0.7
3.如图是温度和压强对X+Y⇌2Z反应影响的示意图。图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是( )组卷:274引用:8难度:0.7 -
4.用水稀释0.1mol•L-1的NH3•H2O溶液,其中随水的量增加而增大的是( )
①c(OH-)
②n(OH-)
③c(OH-)c(NH3•H2O)
④c(NH3•H2O)c(H+)
⑤c(NH4+)组卷:14引用:3难度:0.6 -
5.德国哈伯发明以低成本制造大量氨的方法,流程图中为提高原料转化率而采取措施是( )
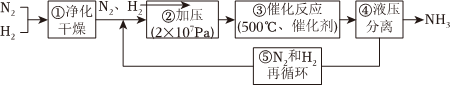 组卷:210引用:13难度:0.7
组卷:210引用:13难度:0.7 -
6.下列按强电解质、弱电解质、酸性氧化物、碱性氧化物的组合,正确的是( )
选项 强电解质 弱电解质 酸性氧化物 碱性氧化物 A Ca(OH)2 酒精 N2O5 Na2O B CaSO4 H2CO3 SO2 CaO C NaHCO3 氨水 Mn2O7 Al2O3 D HCl HF CO Na2O2 组卷:255引用:4难度:0.6
二、非选择题:(共56分)。
-
19.重铬酸钠晶体(Na2Cr2O7•H2O)为橙红色,是一种重要的无机盐产品。可以由铬铁矿[主要含Fe(CrO2)2,还含少量MgO、Al2O3、SiO2等]制备,主要工艺流程如图:
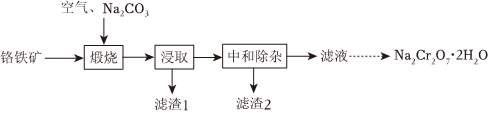
已知:①Cr(VI)在水溶液中常以H2CrO4、、HCrO-4、Cr2CrO2-4等形态存在;本实验条件下,当pH约为3.5时O2-7转化为Cr2CrO2-4。O2-7
②酸性条件下,Cr(VI)具有较强的氧化性,易被还原成Cr(III)。
请回答下列问题:
(1)“煅烧”时,Fe(CrO2)2转化为Na2CrO4和Fe2O3,写出铬铁矿发生的主要反应的化学方程式。
(2)“中和除杂”时,先用水将浸取液稀释,并加热至接近沸腾,然后调节溶液pH约为7。
①加热至接近沸腾的目的为。
②若持续加热较长时间,可以通过生成Na2O•Al2O3•2SiO2•2H2O而将硅除去,写出相应的离子方程式。
(3)室温下,“中和除杂”后所得的滤液中存在下列平衡;
H2CrO4⇌H++K1=4.1HCrO-4⇌H++HCrO-4K2=3.0×10-7CrO2-4
2⇌Cr2HCrO2-4+H2O K3=45O2-7
①室温下,反应2+2H+⇌Cr2CrO2-4+H2O的平衡常数K=O2-7;酸化时,通常用硫酸而不用盐酸,原因是CrO2-4。
②如图为Na2SO4和Na2Cr2O7的溶解度随温度变化关系曲线。由“中和除杂”后所得的滤液制备重铬酸钠晶体的实验方案为。(必须使用的试剂有:硫酸、蒸馏水)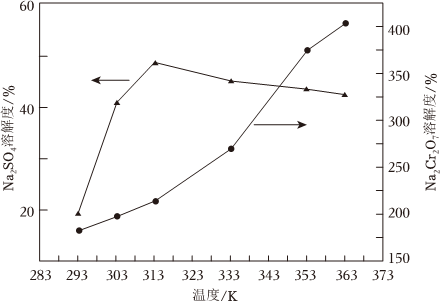 组卷:38引用:3难度:0.5
组卷:38引用:3难度:0.5 -
20.(1)分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是
(填字母)。(①表示盐酸,②表示醋酸)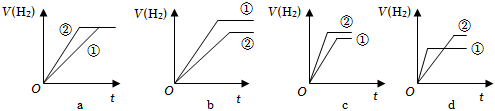
(2)常温下,浓度均为0.1mol•L-1的下列五种钠盐溶液的pH如下表;
上述盐溶液中的阴离子,结合H+能力最强的溶质 CH3COONa NaHCO3 Na2CO3 NaClO NaCN pH 8.8 9.7 11.6 10.3 11.1 ,根据表中数据,浓度均为0.01mol•L-1的下列四种酸的溶液分别稀释100倍,pH变化最大的是(填编号)。
A.HCN
B.HClO
C.CH3COOH
D.H2CO3
(3)常温下,有下列2种溶液:盐酸、醋酸。
①向等体积、等浓度的盐酸和醋酸溶液中加入大小相同的镁条,开始时反应速率分别为v1、v2,其大小关系为。
②等体积、等pH的的盐酸和醋酸溶液分别与足量的等浓度的NaOH溶液反应,消耗NaOH溶液的体积分别为a、b,其大小关系为。
(4)25℃时,两种酸的电离平衡常数如下表。
①在相同条件下,试比较H2CO3、Ka1 Ka2 H2SO3 1.3×10-2 6.3×10-8 H2CO3 4.2×10-7 5.6×10-11 和HCO-3的酸性从强到弱顺序为HSO-3。
②向Na2CO3溶液中加入足量NaHSO3溶液,反应的离子方程式为。组卷:8引用:2难度:0.6


