2022-2023学年福建省龙岩市一级联盟校(九校)联考高二(上)期中化学试卷
发布:2024/9/22 4:0:8
一、选择题:(本题共10小题,每小题4分,共40分。在每小题给出的四个选项中,只有一项是符合题目要求的)
-
1.下列工作过程中,涉及将化学能直接转化为电能过程的是( )
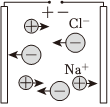



A.熔融NaCl导电 B.硅太阳能电池发电 C.热电厂火力发电 D.电动汽车行驶 组卷:1引用:2难度:0.7 -
2.下列说法正确的是( )
组卷:5引用:2难度:0.7 -
3.下列说法正确的是( )
组卷:11引用:2难度:0.5 -
4.下列有关电化学实验装置或图示的说法错误的是( )
组卷:18引用:2难度:0.5 -
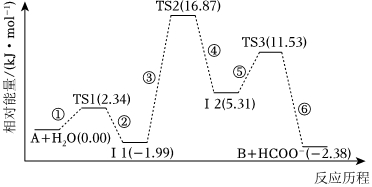 5.已知化合物A与H2O在一定条件下反应生成化合物B与HCOO-,其反应历程如图所示,其中TS表示过渡态,Ⅰ表示中间体。下列说法正确的是( )组卷:88引用:28难度:0.6
5.已知化合物A与H2O在一定条件下反应生成化合物B与HCOO-,其反应历程如图所示,其中TS表示过渡态,Ⅰ表示中间体。下列说法正确的是( )组卷:88引用:28难度:0.6
二、非选择题:(本题共5小题,共60分)
-
14.化学反应速率与限度跟生产、生活密切相关。
(1)某学生为了探究锌与盐酸反应过程中的速率变化,他在400mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如表(累计值,设溶液体积不变):
①下列时间段反应速率最快的是时间/min 1 2 3 4 5 氢气体积/mL(标准状况) 100 240 464 576 620 。
A.0~1min
B.1~2min
C.2~3min
D.3~4min
E.4~5min
②2~4min时间段以盐酸的浓度变化来表示的该反应速率v(HCl)=。
(2)已知反应:Fe3++3SCN-⇌Fe(SCN)3。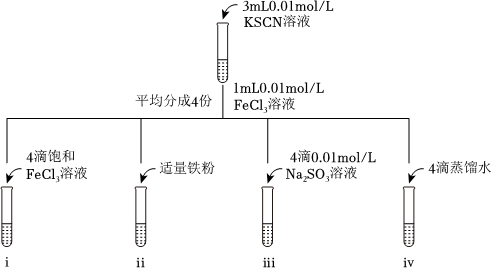
①i中现象为。
②ii中血红色褪去,结合离子反应和平衡移动解释原因。
③已知存在反应:2Fe3+++H2O═2Fe2++SO2-3+2H+,则证明iii中平衡逆向移动的准确实验现象描述是SO2-4。
(3)已知反应:[Cu(H2O)4]2+(蓝色)+4Cl-⇌[CuCl4]2-(黄色)+4H2O ΔH>0。取适量CuCl2固体进行下面实验: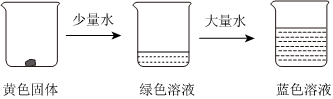 ①下列说法正确的是 。
①下列说法正确的是 。
A.加少量水,溶液为绿色的原因是:溶液中同时存在较多的[Cu(H2O)4]2+和[CuCl4]2-,黄色和蓝色的混合色为绿色
B.加大量水,溶液变为蓝色的原因是:提高了c(H2O),平衡逆向移动,黄色的[CuCl4]2-转化为蓝色的[Cu(H2O)4]2+,所以溶液变为蓝色
C.对绿色溶液进行加热,溶液变为黄绿色,因为反应吸热,升温平衡正向移动
②将CuCl2溶于浓盐酸中,测定平衡体系中:[Cu(H2O)4]2+浓度为amol•L-1、Cl-浓度为bmol•L-1、[CuCl4]2-浓度为cmol•L-1,则Cl-的转化率为(用a、b、c中的字母表示)。组卷:17引用:2难度:0.5 -
15.亚硝酰氯(NOCl)是有机合成中的重要试剂,可由NO和Cl2反应得到,化学方程式为2NO(g)+Cl2(g)⇌2NOCl(g)。
(1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酰氯,涉及如下反应:
①2NO2(g)+NaCl(s)⇌NaNO3(s)+NOCl(g)K1
②4NO2(g)+2NaCl(s)⇌2NaNO3(s)+2NO(g)+Cl2(g)K2
③2NO(g)+Cl2(g)⇌2NOCl(g)K3
反应①②③对应的平衡常数依次为K1、K2、K3,则K3与K1、K2之间的关系为。
(2)300℃时,2NOCl(g)⇌2NO(g)+Cl2(g)。正反应速率的表达式为v正═k•cn(NOCl)(k为带有单位的速率常数,其值只与温度有关),测得速率与浓度的关系如表所示:
n═序号 c(NOCl)/mol•L-1 v正/mol•L-1•s-1 ① 0.30 3.60×10-9 ② 0.60 l.44×10-8 ③ 0.90 3.24×10-8 ,k═。
(3)25℃时,向体积为2L且带气压计的恒容密闭容器中通入一定量NO和Cl2合成NOCl,方程式为2NO(g)+Cl2(g)⇌2NOCl(g)ΔH若反应起始和平衡时温度相同,测得反应过程中压强(p)随时间(t)的变化如图1曲线a所示,则ΔH(填“>”“<”或“不确定”)0;若其他条件相同,仅改变某一条件时,测得其压强(p)随时间(t)的变化如图1曲线b所示,则改变的条件是。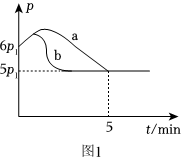
(4)若把2molNO和1molCl2加入到一恒压的密闭容器中发生反应,平衡时NO的转化率与温度T、压强p(总压)的关系如图2所示,若反应一直保持在p压强条件下进行,则M点的分压平衡常数Kp═(用含p的表达式表示,用平衡分压代替平衡浓度计算,分压═总压×体积分数)。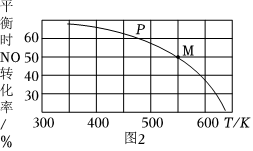 组卷:5引用:2难度:0.5
组卷:5引用:2难度:0.5


