2023年北京市高考化学试卷(等级性)
发布:2024/5/20 8:0:9
一、选择题(共14小题,每小题3分,满分42分)
-
1.中国科学家首次成功制得大面积单晶石墨炔,是碳材料科学的一大进步。
下列关于金刚石、石墨、石墨炔的说法正确的是( )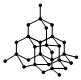
金刚石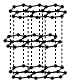
石墨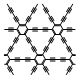
石墨炔组卷:578引用:16难度:0.6 -
2.下列化学用语或图示表达正确的是( )
组卷:395引用:10难度:0.6 -
3.下列过程与水解反应无关的是( )
组卷:468引用:6难度:0.7 -
4.下列事实能用平衡移动原理解释的是( )
组卷:476引用:13难度:0.6 -
5.回收利用工业废气中的CO2和SO2,实验原理示意图如图。
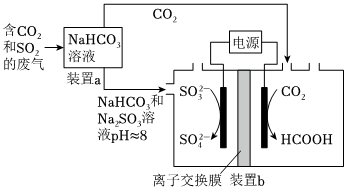
下列说法不正确的是( )组卷:443引用:8难度:0.5 -
6.下列离子方程式与所给事实不相符的是( )
组卷:1078引用:12难度:0.6
二、解答题(共5小题,满分58分)
-
18.以银锰精矿(主要含Ag2S、MnS、FeS2)和氧化锰矿(主要含MnO2)为原料联合提取银和锰的一种流程示意图如图。
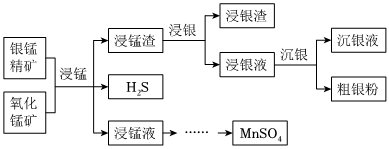
已知:酸性条件下,MnO2的氧化性强于Fe3+。
(1)“浸锰”过程是在H2SO4溶液中使矿石中的锰元素浸出,同时去除FeS2,有利于后续银的浸出;矿石中的银以Ag2S的形式残留于浸锰渣中。
①“浸锰”过程中,发生反应MnS+2H+═Mn2++H2S↑,则可推断:Ksp(MnS)(填“>”或“<”)Ksp(Ag2S)。
②在H2SO4溶液中,银锰精矿中的FeS2和氧化锰矿中的MnO2发生反应,则浸锰液中主要的金属阳离子有。
(2)“浸银”时,使用过量FeCl3、HCl和CaCl2的混合液作为浸出剂,将Ag2S中的银以[AgCl2]-形式浸出。
①将“浸银”反应的离子方程式补充完整:Fe3++Ag2S+⇌+2[AgCl2]-+S。
②结合平衡移动原理,解释浸出剂中Cl-、H+的作用:。
(3)“沉银”过程中需要过量的铁粉作为还原剂。
①该步反应的离子方程式有。
②一定温度下,Ag的沉淀率随反应时间的变化如图所示。解释t分钟后Ag的沉淀率逐渐减小的原因:。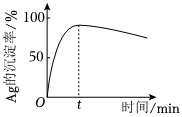
(4)结合“浸锰”过程,从两种矿石中各物质利用的角度,分析联合提取银和锰的优势:。组卷:484引用:5难度:0.5 -
 19.资料显示,I2可以将Cu氧化为Cu2+。某小组同学设计实验探究Cu被I2氧化的产物及铜元素的价态。
19.资料显示,I2可以将Cu氧化为Cu2+。某小组同学设计实验探究Cu被I2氧化的产物及铜元素的价态。
已知:I2易溶于KI溶液,发生反应I2+I-⇌(红棕色);I2和I-3氧化性几乎相同。I-3
(1)将等体积的KI溶液加入到mmol铜粉和nmolI2(n>m)的固体混合物中,振荡。
实验记录如下:
①初始阶段,Cu被氧化的反应速率:实验Ⅰc(KI) 实验现象 实验Ⅰ 0.01mol•L-1 极少量I2溶解,溶液为淡红色;充分反应后,红色的铜粉转化为白色沉淀,溶液仍为淡红色 实验Ⅱ 0.1mol•L-1 部分I2溶解,溶液为红棕色;充分反应后,红色的铜粉转化为白色沉淀,溶液仍为红棕色 实验Ⅲ 4mol•L-1 I2完全溶解,溶液为深红棕色;充分反应后,红色的铜粉完全溶解,溶液为深红棕色 (填“>”“<”或“=”)实验Ⅱ。
②实验Ⅲ所得溶液中,被氧化的铜元素的可能存在形式有[Cu(H2O)4]2+(蓝色)或[CuI2]-(无色),进行以下实验探究:
步骤a.取实验Ⅲ的深红棕色溶液,加入CCl4,多次萃取、分液。
步骤b.取分液后的无色水溶液,滴入浓氨水。溶液颜色变浅蓝色,并逐渐变深。
i.步骤a的目的是。
ii.查阅资料,2Cu2++4I-═2CuI↓+I2,[Cu(NH3)2]+(无色)容易被空气氧化。用离子方程式解释步骤b的溶液中发生的变化:。
③结合实验Ⅲ,推测实验Ⅰ和Ⅱ中的白色沉淀可能是CuI,实验Ⅰ中铜被氧化的化学方程式是。分别取实验Ⅰ和Ⅱ充分反应后的固体,洗涤后得到白色沉淀,加入浓KI溶液,(填实验现象),观察到少量红色的铜。分析铜未完全反应的原因是。
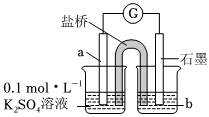
(2)上述实验结果,I2仅将Cu氧化为+1价。在隔绝空气的条件下进行电化学实验,证实了I2能将Cu氧化为Cu2+。装置如图所示,a、b分别是。
(3)运用氧化还原反应规律,分析在上述实验中Cu被I2氧化的产物中价态不同的原因:。组卷:510引用:3难度:0.6


