 资料显示,I2可以将Cu氧化为Cu2+。某小组同学设计实验探究Cu被I2氧化的产物及铜元素的价态。
资料显示,I2可以将Cu氧化为Cu2+。某小组同学设计实验探究Cu被I2氧化的产物及铜元素的价态。
已知:I2易溶于KI溶液,发生反应I2+I-⇌I-3(红棕色);I2和I-3氧化性几乎相同。
(1)将等体积的KI溶液加入到mmol铜粉和nmolI2(n>m)的固体混合物中,振荡。
实验记录如下:
I
-
3
I
-
3
| c(KI) | 实验现象 | |
| 实验Ⅰ | 0.01mol•L-1 | 极少量I2溶解,溶液为淡红色;充分反应后,红色的铜粉转化为白色沉淀,溶液仍为淡红色 |
| 实验Ⅱ | 0.1mol•L-1 | 部分I2溶解,溶液为红棕色;充分反应后,红色的铜粉转化为白色沉淀,溶液仍为红棕色 |
| 实验Ⅲ | 4mol•L-1 | I2完全溶解,溶液为深红棕色;充分反应后,红色的铜粉完全溶解,溶液为深红棕色 |
<
<
(填“>”“<”或“=”)实验Ⅱ。②实验Ⅲ所得溶液中,被氧化的铜元素的可能存在形式有[Cu(H2O)4]2+(蓝色)或[CuI2]-(无色),进行以下实验探究:
步骤a.取实验Ⅲ的深红棕色溶液,加入CCl4,多次萃取、分液。
步骤b.取分液后的无色水溶液,滴入浓氨水。溶液颜色变浅蓝色,并逐渐变深。
i.步骤a的目的是
除去,防止干扰后续实验
I
-
3
除去,防止干扰后续实验
。I
-
3
ii.查阅资料,2Cu2++4I-═2CuI↓+I2,[Cu(NH3)2]+(无色)容易被空气氧化。用离子方程式解释步骤b的溶液中发生的变化:
[CuI2]-+2NH3•H2O=[Cu(NH3)2]++2I-+2H2O,4[Cu(NH3)2]++O2+8NH3•H2O=4[Cu(NH3)4]2++4OH-+6H2O
[CuI2]-+2NH3•H2O=[Cu(NH3)2]++2I-+2H2O,4[Cu(NH3)2]++O2+8NH3•H2O=4[Cu(NH3)4]2++4OH-+6H2O
。③结合实验Ⅲ,推测实验Ⅰ和Ⅱ中的白色沉淀可能是CuI,实验Ⅰ中铜被氧化的化学方程式是
2Cu+I2═2CuI(或2Cu+KI3═2CuI+KI)
2Cu+I2═2CuI(或2Cu+KI3═2CuI+KI)
。分别取实验Ⅰ和Ⅱ充分反应后的固体,洗涤后得到白色沉淀,加入浓KI溶液,白色沉淀逐渐溶解,溶液变为无色
白色沉淀逐渐溶解,溶液变为无色
(填实验现象),观察到少量红色的铜。分析铜未完全反应的原因是 铜与碘的反应为可逆反应(或 浓度小,未能氧化全部的Cu)
l
-
3
铜与碘的反应为可逆反应(或 浓度小,未能氧化全部的Cu)
。l
-
3
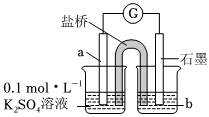
(2)上述实验结果,I2仅将Cu氧化为+1价。在隔绝空气的条件下进行电化学实验,证实了I2能将Cu氧化为Cu2+。装置如图所示,a、b分别是
铜;含nmolI2的4mol⋅L-1的KI溶液
铜;含nmolI2的4mol⋅L-1的KI溶液
。(3)运用氧化还原反应规律,分析在上述实验中Cu被I2氧化的产物中价态不同的原因:
铜与碘反应的体系在原电池装置中,I2将Cu 氧化为Cu2+;而在实验Ⅰ、实验Ⅱ和实验Ⅲ中Cu以Cu+形式存在,这是由于在实验Ⅰ、实验Ⅱ、实验Ⅲ中Cu+可以进一步与I-结合生成CuI沉淀或[CuI2]-,Cu+浓度减小使得Cu2+氧化性增强,发生反应2Cu2++4I-═2CuI↓+I2和2Cu2++6I-═2[CuI2]-+I2
铜与碘反应的体系在原电池装置中,I2将Cu 氧化为Cu2+;而在实验Ⅰ、实验Ⅱ和实验Ⅲ中Cu以Cu+形式存在,这是由于在实验Ⅰ、实验Ⅱ、实验Ⅲ中Cu+可以进一步与I-结合生成CuI沉淀或[CuI2]-,Cu+浓度减小使得Cu2+氧化性增强,发生反应2Cu2++4I-═2CuI↓+I2和2Cu2++6I-═2[CuI2]-+I2
。【考点】性质实验方案的设计;氧化还原反应的基本概念及规律.
【答案】<;除去,防止干扰后续实验;[CuI2]-+2NH3•H2O=[Cu(NH3)2]++2I-+2H2O,4[Cu(NH3)2]++O2+8NH3•H2O=4[Cu(NH3)4]2++4OH-+6H2O;2Cu+I2═2CuI(或2Cu+KI3═2CuI+KI);白色沉淀逐渐溶解,溶液变为无色;铜与碘的反应为可逆反应(或 浓度小,未能氧化全部的Cu);铜;含nmolI2的4mol⋅L-1的KI溶液;铜与碘反应的体系在原电池装置中,I2将Cu 氧化为Cu2+;而在实验Ⅰ、实验Ⅱ和实验Ⅲ中Cu以Cu+形式存在,这是由于在实验Ⅰ、实验Ⅱ、实验Ⅲ中Cu+可以进一步与I-结合生成CuI沉淀或[CuI2]-,Cu+浓度减小使得Cu2+氧化性增强,发生反应2Cu2++4I-═2CuI↓+I2和2Cu2++6I-═2[CuI2]-+I2
I
-
3
l
-
3
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/5/17 8:0:8组卷:510引用:3难度:0.6
相似题
-
1.如图是在实验室进行二氧化硫制备与性质实验的组合装置,部分固定装置未画出。
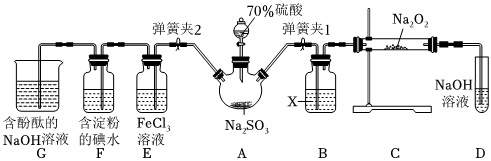
(1)在组装好装置后,若要检验A~D装置的气密性,其操作是首先,然后往D中装入水,然后微热A,观察到D中有气泡冒出,移开酒精灯或松开双手,D中导管有水柱形成且高度保持不变,说明装置气密性良好。
(2)装置D中盛放NaOH溶液的作用是。
(3)关闭弹簧夹1后,打开弹簧夹2,残余气体进入E、F、G中,能说明I-还原性弱于SO2的现象为;发生反应的离子方程式是。
(4)为了验证E中SO2与FeCl3发生了氧化还原反应,设计了如下实验:取E中的溶液,往溶液中加入用稀硝酸酸化的BaCl2溶液,产生白色沉淀,说明SO2与FeCl3发生了氧化还原反应。上述方案是否合理?(填“合理”或“不合理”),原因是。
(5)实验过程中G中含酚酞的NaOH溶液逐渐褪色,此实验证明SO2具有漂白性还是其溶于水显酸性?请设计实验验证:。发布:2024/12/30 14:0:1组卷:29引用:2难度:0.5 -
2.某化学兴趣小组为探究铜跟浓硫酸的反应,用图装置进行有关实验.请回答下列问题:
(1)装置A中发生的化学反应的化学方程式为.
(2)装置B 的作用是贮存多余的气体,B中广口瓶内应盛放的液体是(填序号)
①水 ②酸性KMnO4 ③Na2CO3溶液 ④饱和的NaHSO3溶液
(3)装置C和D 中产生的现象相同,但原因却不同.用离子方程式和必要的文字解释C中溶液褪色的原因
(4)装置D中试管口塞一团棉花,棉花中应浸有一种液体,这种液体是.
(5)实验完毕,待A中烧瓶内液体冷却后,过滤,向滤液中加入少量的蒸馏水稀释,溶液为蓝色.为了证明蓝色只与Cu2+有关,而与其它离子无关,某同学设计了下列实验,其中对实验目的没有意义的是(填序号)
①观察稀H2SO4 溶液呈无色 ②观察CuSO4 粉末呈白色 ③稀释CuSO4溶液,溶液蓝色变浅 ④往CuSO4溶液中加入足量NaOH溶液,生成蓝色沉淀,过滤,滤液呈无色⑤往CuSO4溶液中加入足量BaCl2的溶液,生成白色沉淀,过滤,滤液仍显蓝色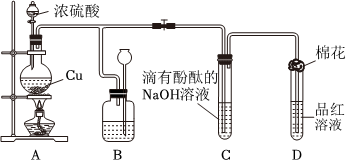 发布:2024/12/30 14:30:1组卷:13引用:2难度:0.7
发布:2024/12/30 14:30:1组卷:13引用:2难度:0.7 -
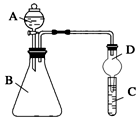 3.某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验。
3.某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验。
Ⅰ.(1)将钠、钾、镁、铝各1mol分别投入到足量的同浓度的盐酸中,试预测实验结果:与盐酸反应最剧烈,与盐酸反应产生的气体最多。(填元素符号)
(2)向Na2S溶液中通入氯气出现黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为:。
Ⅱ.利用如图装置可验证同主族元素非金属性的变化规律
(1)仪器A的名称为。
(2)实验室中现有药品:①稀盐酸 ②稀硝酸 ③Na2SiO3溶液 ④Na2CO3固体,请选择合适药品设计实验验证 N、C、Si的非金属性的变化规律;装置A、B中所装药品分别为、。(填序号)但有同学认为该装置有缺陷,如何改进?。发布:2024/12/30 14:30:1组卷:19引用:2难度:0.5
相关试卷


