2022-2023学年上海市曹杨二中高一(下)期末化学试卷
发布:2024/7/30 8:0:9
一、解答题
-
1.氮元素是植物生长的必备元素之一,将空气中的游离态氮转化为化合态氮的过程称为固氮,其主要方式有天然固氮和人工固氮。海洋中无机氮的循环过程可用如图1表示:
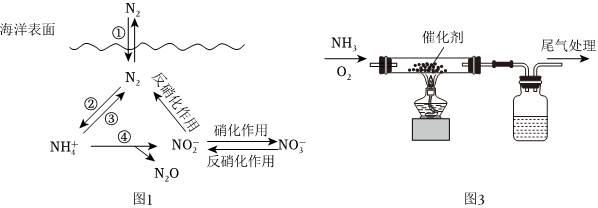
(1)海洋中的氮循环属于固氮作用的一步是(填图中数字序号)。
(2)下列关于海洋氮循环的说法正确的是。
A.海洋中只存在化合态的氮
B.海洋中的氮循环起始于氮的氧化
C.海洋中的反硝化作用一定有氧气的参与
D.向海洋排放含的废水会影响海洋中NO-3的含量NH+4
(3)人工固氮方式主要通过合成氨反应,科学家证实了N2与H2在固体催化剂表面全成氨的反应过程,示意图如图2: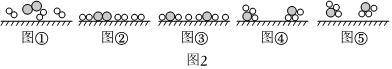
下列说法正确的是。
A.图①可看出N2、H2分子中均为单键
B.图③到图④的过程向外释放能量
C.升高温度一定提高一段时间内NH3的产率
D.合成氨反应达平衡,反应速率关系:3v正(H2)=2v逆(NH3)
工业以氨气为原料制备硝酸,尾气中常含有NO、NO2,可用不同方法吸收。
(4)如图3为氨催化氧化的实验装置。实验过程中集气瓶中有白烟产生,该白烟可能是。
A.HNO3
B.NO2
C.NH4NO3
D.NH4Cl
(5)水吸收法。结合化学方程式说明用水吸收NO2的缺陷。
(6)溶液吸收法。发生的反应有:
①2NaOH+NO+NO2→2NaNO2+H2O
②NaOH+NO2→+NaNO2+H2O(填化学式,无需配平)。组卷:68引用:1难度:0.5
-
4.工业制硫酸中的一步重要反应是SO2在400~500℃下的催化氧化。
(1)根据图甲,该反应是(填“放热”或者“吸热”)反应。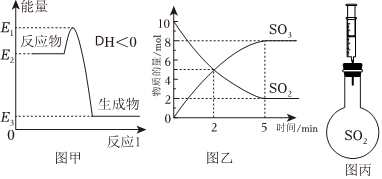
(2)让反应在恒容密闭容器进行,下列说法正确的是(双选)。
A.使用催化剂V2O5是为了增大反应速率,提高生产效率
B.通往少量He,生成SO3的反应速率增大
C.生产时选择常压,是考虑对速率和生产设备的要求
D.工业上用98.3%的浓硫酸吸SO3制得发烟硫酸
(3)下列情况不能说明反应一定达到化学平衡状态的是。
A.SO3的质量保持不变
B.O2的含量保持不变
C.2v正(O2)=v逆(SO2)
D.SO2、O2、SO3的物质的量之比为2:1:2
(4)容积为2L的恒温密闭容器中通入10molSO2和5molO2,反应过程中部分物质的物质的量随反应时间变化的曲线如图乙所示。恒温恒容时,下列措施能使该反应速率增大的是(双选)。
A.增加O2的浓度
B.选择高效催化剂
C.充入氦气
D.适当降低温度
(5)2min时,v正(SO2)v逆(SO2)(填“>”、“<”或“=”)。
(6)在图乙中画出O2的物质的量随反应时间变化的曲线。
(7)将0.050molSO2(g)和0.030molO2(g)放入容积为1.0L的密闭容器中,在一定条件下发生反应,5.0min达到平衡,测得c(SO3)=0.040mol/L。则该条件下反应SO2的转化率为%【转化率=×100%】,这段时间内O2的平均反应速率为发生反应的SO2的物质的量原有的SO2的物质的量。
(8)恒温恒容下,A容器中加入1gSO2和1gO2反应达到平衡,SO2的转化率为a%,另一同温同容的B容器中加入2gSO2和2gO2反应达到平衡,SO2的转化率为b%,则比较大小:a%b%。
(9)用如图丙装置探究SO2的性质。限选试剂:NaOH溶液、稀H2SO4、H2O2溶液、FeCl3溶液、淀粉、KI溶液、新制H2S溶液。操作步骤 预期现象 解释原因 用注射器将新制H2S溶液注入充满SO2的烧瓶 产生乳白色浑浊 +4价S具有 性,方程式为。用注射器将 溶液注入充满SO2的烧瓶中+4价S具有还原性 组卷:37引用:1难度:0.6 -
5.从石器、青铜器到铁器时代,金属的冶炼体现了人类文明的进程,铁是应用最广泛的金属,被人类誉为金属之王;而铝在地壳中的含量比铁更高,居于榜首。

(1)如图表示了三种金属被人类开发利用的大致年限,之所以有先后,主要取决于。
A.金属的化合价高低
B.金属的活动性强弱
C.金属的导电性强弱
D.金属在地壳中的含量多少
(2)下列反应符合如图图示的是。
A.铁在氧气中燃烧
B.铁粉和硫粉反应
C.煅烧石灰石
D.铁片与硫酸反应
(3)野外铺设钢轨时,通常用铝和氧化铁混合粉末反应得到的液态铁来焊接钢轨。常用如图所示装置,下列叙述错误的是。
A.该反应属于置换反应
B.有“熔融铁珠”生成说明该反应为放热反应
C.该反应的化学能全部转化为热能
D.该反应中生成物的总能量小于反应物的总能量
(4)写出上述反应的化学方程式,其中铝作。(填“氧化剂”或“还原剂”)
(5)下列情况中,铁的腐蚀最快的是。
A.Fe-Al/NaOH(aq)原电池
B.Fe-Al/浓HNO3原电池
C.Fe-C/H2SO4(aq)原电池
D.Fe-C/NaCl(aq)原电池
(6)欲除去铁粉中混有的铝粉,可以选用的试剂为。
A.稀盐酸
B.氢氧化钠溶液
C.浓硫酸
D.FeCl3溶液
(7)在氯化铝溶液中逐滴滴入过量的氢氧化钠溶液,观察到的现象是。
A.只放出气体
B.产生白色沉淀,随后沉淀溶解
C.只产生白色沉淀
D.既产生白色沉淀,又放出白色气体
(8)将3mol/L氢氧化钠溶液滴入到25mL一定浓度的氯化铝溶液中,如图是整个过程的数学分析曲线,其中横轴表示加入OH-的物质的量,纵轴表示产生的沉淀物质的量。图中OA曲线表示的离子反应是,由此可得A点的坐标为;AB曲线表示的离子反应是,由此可得B点的坐标为。由上述分析可求氯化铝溶液中Al3+离子的浓度为。 组卷:97引用:1难度:0.5
组卷:97引用:1难度:0.5


