从石器、青铜器到铁器时代,金属的冶炼体现了人类文明的进程,铁是应用最广泛的金属,被人类誉为金属之王;而铝在地壳中的含量比铁更高,居于榜首。

(1)如图表示了三种金属被人类开发利用的大致年限,之所以有先后,主要取决于 BB。
A.金属的化合价高低
B.金属的活动性强弱
C.金属的导电性强弱
D.金属在地壳中的含量多少
(2)下列反应符合如图图示的是 CC。

A.铁在氧气中燃烧
B.铁粉和硫粉反应
C.煅烧石灰石
D.铁片与硫酸反应
(3)野外铺设钢轨时,通常用铝和氧化铁混合粉末反应得到的液态铁来焊接钢轨。常用如图所示装置,下列叙述错误的是 CC。

A.该反应属于置换反应
B.有“熔融铁珠”生成说明该反应为放热反应
C.该反应的化学能全部转化为热能
D.该反应中生成物的总能量小于反应物的总能量
(4)写出上述反应的化学方程式 2Al+Fe2O3 高温 2Fe+Al2O32Al+Fe2O3 高温 2Fe+Al2O3,其中铝作 还原剂还原剂。(填“氧化剂”或“还原剂”)
(5)下列情况中,铁的腐蚀最快的是 CC。
A.Fe-Al/NaOH(aq)原电池
B.Fe-Al/浓HNO3原电池
C.Fe-C/H2SO4(aq)原电池
D.Fe-C/NaCl(aq)原电池
(6)欲除去铁粉中混有的铝粉,可以选用的试剂为 BB。
A.稀盐酸
B.氢氧化钠溶液
C.浓硫酸
D.FeCl3溶液
(7)在氯化铝溶液中逐滴滴入过量的氢氧化钠溶液,观察到的现象是 BB。
A.只放出气体
B.产生白色沉淀,随后沉淀溶解
C.只产生白色沉淀
D.既产生白色沉淀,又放出白色气体
(8)将3mol/L氢氧化钠溶液滴入到25mL一定浓度的氯化铝溶液中,如图是整个过程的数学分析曲线,其中横轴表示加入OH-的物质的量,纵轴表示产生的沉淀物质的量。图中OA曲线表示的离子反应是 Al3++3OH-=Al(OH)3↓Al3++3OH-=Al(OH)3↓,由此可得A点的坐标为 (0.03,0.01)(0.03,0.01);AB曲线表示的离子反应是 Al(OH)3↓+OH-=AlO-2+2H2OAl(OH)3↓+OH-=AlO-2+2H2O,由此可得B点的坐标为 (0.04,0)(0.04,0)。由上述分析可求氯化铝溶液中Al3+离子的浓度为 0.4mol/L0.4mol/L。

高温
高温
A
l
O
-
2
A
l
O
-
2
【答案】B;C;C;2Al+Fe2O3 2Fe+Al2O3;还原剂;C;B;B;Al3++3OH-=Al(OH)3↓;(0.03,0.01);Al(OH)3↓+OH-=+2H2O;(0.04,0);0.4mol/L
高温
A
l
O
-
2
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/7/5 8:0:9组卷:97引用:1难度:0.5
相似题
-
 1.按要求回答下列问题:
1.按要求回答下列问题:
(1)实验室铝粉和Fe2O3作铝热反应实验,铝热反应的方程式为,该实验中除用到铝粉和Fe2O3外,需要的试剂还有(填编号).
a.KClO3 b.Mg c.MnO2 d.KCl
(2)据文献报道,在实际反应中铝热反应的产物成分较为复杂.某课题组对铝热反应产物的成分进行探究,经成分分析,发现主要得到甲和乙两种产物.甲由具有相同电子层结构的阴、阳离子构成;乙是一种铁铝的金属互化物(可用FexAly表示),取该合金粉末2.47g,滴加足量浓NaOH溶液,充分搅拌、过滤、洗涤得固体.再将所得固体在空气中充分加热、灼烧得红棕色粉末1.60g.
①甲的化学式为,乙中x=,y=.
②甲的晶体是耐高温材料,用此材料做成的坩埚,不能用来熔融NaOH,用化学方程式解释其原因;
含二氧化硅材料做成的坩埚(填“能”或“不能”)用来熔融NaOH.
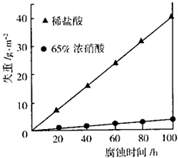
③如图表示室温下相同组分的乙分别在两种不同的酸中的腐蚀情况,由图可知,乙在中具有比较强的抗腐蚀性,原因可能是.
④研究发现铝热反应后期温度高达2000℃以上时会有极微量的Al4C3生成,Al4C3遇水会产生一种气体,该气体的分子式为.[已知CaC2+2H2O═Ca(OH)2+C2H2↑]
(3)镁铝互化物(Mg17Al12)是一种潜在的贮氢材料,该金属互化物在一定条件下完全吸氢的反应方程式为Mg17Al12+17H2═17MgH2+12Al.得到的混合物在6.0mol•L-1HCl中,能完全释放出H2.1mol Mg17Al12完全吸氢后得到的混合物与上述盐酸完全反应,释放出H2的物质的量为.发布:2024/12/6 8:0:2组卷:24引用:1难度:0.3 -
2.“铝热反应”是一种重要的化学反应,下列说法正确的是( )
发布:2025/1/21 8:0:1组卷:48引用:1难度:0.9 -
3.下列关于铝热反应的说法错误的是( )
发布:2025/1/21 8:0:1组卷:13引用:3难度:0.6


