2022-2023学年北京市东城区高二(下)期末化学试卷
发布:2024/8/6 8:0:9
一、本部分共14题,每题3分,共42分。在每题列出的四个选项中,选出最符合题目要求的一项。
-
1.下列产品的主要成分为合成高分子材料的是( )
组卷:42引用:1难度:0.8 -
2.下列物质属于酮的是( )
组卷:102引用:2难度:0.5 -
3.下列有机反应方程式书写不正确的是( )
组卷:24引用:1难度:0.6 -
4.下列微粒的中心原子是sp2杂化的是( )
组卷:52引用:2难度:0.7 -
5.下列说法不正确的是( )
组卷:23引用:2难度:0.7 -
6.下列各组物质既能用溴水鉴别,也能用酸性高锰酸钾溶液鉴别的是( )
组卷:51引用:3难度:0.7
第二部分本部分共5题,共58分。
-
18.利用NaCl晶体结构测定阿伏加德罗常数(NA)。
Ⅰ.精制CCl4
粗CCl4中溶有一定量的CS2,试剂a为KOH、H2O、乙醇混合液,用于除去CS2。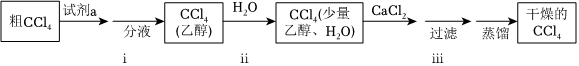
(1)从分子结构角度解释CS2能溶于CCl4的原因:。
(2)步骤ii的目的是除去CCl4中的大量乙醇,该步骤利用的分离提纯方法为。
(3)步骤iii中,CaCl2中的Ca2+可以与H2O和乙醇形成配位键,其中配原子是。
Ⅱ.测定阿伏加德罗常数
实验1:实验装置如图所示,实验步骤如图。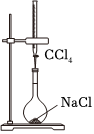
①准确称量25mL容量瓶的质量为m1g。
②将NaCl充分干燥后,转移至上述容量瓶中,准确称量其总重为m2g。
③将精制后的CCl4由滴定管加入容量瓶至刻度线,消耗CCl4的体积为VmL。
(4)结合实验1中的数据可知:实验1的目的是测定NaCl晶体的(填物理量名称)。
实验2:利用X射线衍射实验测定NaCl晶体结构。
NaCl晶体中存在A型和B型两种立方体重复单元(如图所示),且A、B中存在的粒子种类和数目均相同。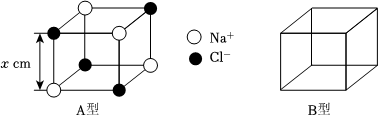
(5)a.从结构的角度解释A型立方体不是NaCl晶胞的原因:。
b.通过平移(不能旋转)A型和B型两种立方体可得到NaCl晶体中粒子排列的周期。用“〇”在B型立方体中标出Na+的位置。
(6)结合实验1和实验2数据,可得NA=mol-1(用代数式表示)。组卷:27引用:2难度:0.5 -
19.某小组同学进行如下实验比较AgCl和AgI的溶度积(Ksp)大小。
【实验Ⅰ】
①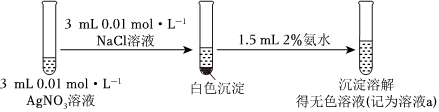
②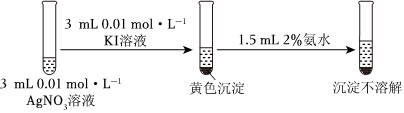
已知:[Ag(NH3)2]+⇌Ag++2NH3
(1)AgNO3中阴离子的VSEPR模型名称是,[Ag(NH3)2]+中Ag+的配位数为。
(2)由上述实验可以得出结论:Ksp(AgCl)>Ksp(AgI)。依据的实验现象是。
为进一步证明上述结论,甲同学设计如下实验。
【实验Ⅱ】将(1)中溶液a分成3等份,并向其中逐滴加入试剂X。
(3)结合③和④,从平衡移动的角度解释③中产生白色沉淀的可能原因:装置 实验编号 试剂X 现象 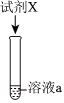
③ 8.5mL0.01mol⋅L-1盐酸 有白色沉淀产生 ④ 8.5mL0.01mol⋅L-1NaCl溶液 无明显现象 ⑤ 4滴0.01mol⋅L-1KI溶液 有黄色沉淀产生 。
(4)对比④和⑤,证实了Ksp(AgCl)>Ksp(AgI)。利用Q、Ksp的关系解释上述结论成立的理由:。
(5)利用0.01mol⋅L-1AgNO3溶液、0.01mol⋅L-1NaCl溶液和0.01mol⋅L-1KI溶液,参照实验Ⅰ呈现形式,设计实验Ⅲ,证明Ksp(AgCl)>Ksp(AgI)。
【实验Ⅲ】
(6)查阅资料可知,影响物质溶解性的因素之一是晶体中共价键成分的百分数。推测Ksp(AgI)比Ksp(AgCl)小的可能原因是:I的电负性比Cl(填“大”或“小”,下同),AgI晶体共价键成分的百分数比AgCl晶体中的。组卷:54引用:2难度:0.6


