某小组同学进行如下实验比较AgCl和AgI的溶度积(Ksp)大小。
【实验Ⅰ】
①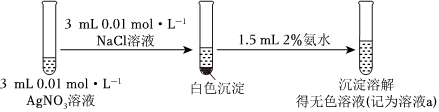
②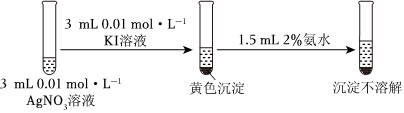
已知:[Ag(NH3)2]+⇌Ag++2NH3
(1)AgNO3中阴离子的VSEPR模型名称是 平面三角形平面三角形,[Ag(NH3)2]+中Ag+的配位数为 22。
(2)由上述实验可以得出结论:Ksp(AgCl)>Ksp(AgI)。依据的实验现象是 ①中白色沉淀溶解,②中黄色沉淀不溶解①中白色沉淀溶解,②中黄色沉淀不溶解。
为进一步证明上述结论,甲同学设计如下实验。
【实验Ⅱ】将(1)中溶液a分成3等份,并向其中逐滴加入试剂X。
| 装置 | 实验编号 | 试剂X | 现象 |
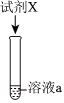 |
③ | 8.5mL0.01mol⋅L-1盐酸 | 有白色沉淀产生 |
| ④ | 8.5mL0.01mol⋅L-1NaCl溶液 | 无明显现象 | |
| ⑤ | 4滴0.01mol⋅L-1KI溶液 | 有黄色沉淀产生 |
③中存在平衡:[Ag(NH3)2]+⇌Ag++2NH3,加入盐酸,H+和NH3反应,c(NH3)降低,平衡右移,c(Ag+)升高,Ag+和Cl-反应生成AgCl沉淀
③中存在平衡:[Ag(NH3)2]+⇌Ag++2NH3,加入盐酸,H+和NH3反应,c(NH3)降低,平衡右移,c(Ag+)升高,Ag+和Cl-反应生成AgCl沉淀
。(4)对比④和⑤,证实了Ksp(AgCl)>Ksp(AgI)。利用Q、Ksp的关系解释上述结论成立的理由:
当均滴到第4滴时,④中Q(AgCl)=c(Ag+)⋅c(Cl-)<Ksp(AgCl),⑤中Q(AgI)=c(Ag+)⋅c(I-)>Ksp(AgI),又因为Q(AgCl)=Q(AgI),故Ksp(AgCl)>Ksp(AgI)
当均滴到第4滴时,④中Q(AgCl)=c(Ag+)⋅c(Cl-)<Ksp(AgCl),⑤中Q(AgI)=c(Ag+)⋅c(I-)>Ksp(AgI),又因为Q(AgCl)=Q(AgI),故Ksp(AgCl)>Ksp(AgI)
。(5)利用0.01mol⋅L-1AgNO3溶液、0.01mol⋅L-1NaCl溶液和0.01mol⋅L-1KI溶液,参照实验Ⅰ呈现形式,设计实验Ⅲ,证明Ksp(AgCl)>Ksp(AgI)



【实验Ⅲ】
(6)查阅资料可知,影响物质溶解性的因素之一是晶体中共价键成分的百分数。推测Ksp(AgI)比Ksp(AgCl)小的可能原因是:I的电负性比Cl
小
小
(填“大”或“小”,下同),AgI晶体共价键成分的百分数比AgCl晶体中的 大
大
。【答案】平面三角形;2;①中白色沉淀溶解,②中黄色沉淀不溶解;③中存在平衡:[Ag(NH3)2]+⇌Ag++2NH3,加入盐酸,H+和NH3反应,c(NH3)降低,平衡右移,c(Ag+)升高,Ag+和Cl-反应生成AgCl沉淀;当均滴到第4滴时,④中Q(AgCl)=c(Ag+)⋅c(Cl-)<Ksp(AgCl),⑤中Q(AgI)=c(Ag+)⋅c(I-)>Ksp(AgI),又因为Q(AgCl)=Q(AgI),故Ksp(AgCl)>Ksp(AgI); ;小;大
;小;大
 ;小;大
;小;大【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/8/6 8:0:9组卷:54引用:2难度:0.6
相似题
-
1.在液氨中投入金属钠,迅速溶剂化得到蓝色电子液[Na+(NH3)x和e-(NH3)y]且过程中有少量H2产生。下列说法正确的是( )
发布:2025/1/4 8:0:1组卷:22引用:3难度:0.6 -
2.ZnSO4溶于氨水形成[Zn(NH3)4]SO4,其中配离子[Zn(NH3)4]2+的立体构型为正四面体形。下列说法正确的是( )
发布:2025/1/5 8:0:1组卷:58引用:1难度:0.5 -
3.Pt(NH3)2Cl2可以形成两种固体,一种为淡黄色,在水中的溶解度小,另一种为黄绿色,在水中的溶解度较大,请回答下列问题:
(1)Pt(NH3 )2 Cl2是平面正方形结构,还是四面体结构.
(2)请画出这两种固体分子的几何构型图,淡黄色固体:. 黄绿色固体:.
(3)淡黄色固体物质是由分子组成,黄绿色固体物质是由分子组成(填“极性分子”或“非极性分子”)发布:2024/12/30 17:0:2组卷:75引用:3难度:0.1


