2022-2023学年山西省部分名校高二(上)期中化学试卷
发布:2024/6/12 8:0:8
一、选择题:本题共15小题,每小题3分,共45分。在每小题给出的四个选项中,只有一项是符合题目要求的。
-
1.生活处处都与化学反应有关,下列生活中发生的反应属于吸热反应的是( )
A.钢铁生锈 B.蒸馒头时小苏打受热分解 C.食物的腐败 D.生石灰制熟石灰 


 组卷:16引用:5难度:0.7
组卷:16引用:5难度:0.7 -
2.下列物质属于弱电解质的是( )
组卷:5引用:1难度:0.7 -
3.将6.5g锌粒投入500mL1mol•L-1盐酸中,10min后锌粒恰好完全溶解(忽略溶液体积的变化)。下列有关该反应速率的表示正确的是( )
组卷:22引用:3难度:0.8 -
4.已知在相同条件下,①NO(g)+O3(g)⇌NO2(g)+O2(g)K1;②NO(g)+
O2(g)⇌NO2(g)K2 ③3NO(g)+O3(g)⇌3NO2(g)K3。则K1,K2、K3的关系正确的是( )12组卷:85引用:2难度:0.6 -
5.相同条件下,有下列三个热化学方程式:
(1)C3H8(l)+5O2(g)═4H2O(l)+3CO2(g)ΔH1=-Q1kJ⋅mol-1
(2)C3H8(g)+5O2(g)═4H2O(l)+3CO2(g)ΔH2=-Q2kJ⋅mol-1
(3)C3H8(l)+5O2(g)═4H2O(g)+3CO2(g)ΔH3=-Q3kJ⋅mol-1
则Q1、Q2、Q3的关系正确的是( )组卷:39引用:3难度:0.5 -
6.下列对于概念的理解正确的是( )
组卷:9引用:3难度:0.7
二、非选择题:本题共4小题,共55分。
-
18.某化学小组欲测定KClO3溶液与NaHSO3溶液反应的化学反应速率,所用试剂为10mL0.1mol•L-1KClO3溶液和10mL0.3mol•L-1NaHSO3溶液,所得溶液中c(Cl-)随时间变化的曲线如图1所示,用Cl-表示的反应速率随时间的变化情况如图2所示。

(1)配平该反应的化学方程式:KClO3+NaHSO3═KCl+Na2SO4+H2SO4。
(2)根据实验数据可知,该反应在0~7min内的平均反应速率v(Cl-)═mol•L-1•min-1。
(3)图2中阴影部分面积表示的是。
(4)分析图2发现,在反应过程中,该反应的反应速率先增大后减小。对于反应速率先增大的原因该小组进行如下探究实验。已知对该反应的反应速率无影响。SO2-4
实验1:向2个烧杯中分别加入10mL0.1mol•L-1KClO3溶液和10mL0.3mol•L-1NaHSO3溶液,将其中一个烧杯在50℃下进行反应。
实验2:分别向2个烧杯中加入10mL0.1mol•L-1KClO3溶液;向烧杯i中加入1mL蒸馏水,向烧杯ii中加入1mL0.1 mol•L-1H2SO4溶液;再分别向2个烧杯中加入10mL0.3mol•L-1NaHSO3溶液。
实验3:取10mL0.1mol•L-1KClO3溶液于烧杯中,先加入少量NaCl固体,再加入10mL0.3mol•L-1NaHSO3溶液。
①实验1探究的是,可以用的方法控制温度为50℃。
②实验2中,向烧杯i中加入1mL蒸馏水的作用是。
③实验3探究的可能是。组卷:51引用:4难度:0.7 -
19.工业废气的排放对环境造成了极大的影响,研究其吸收或再利用对缓解环境污染有重要意义。请根据所学知识回答下列问题。
(1)工业废气中的H2S可用Fe2(SO4)3溶液吸收,反应后的溶液可在硫杆菌的作用下实现吸收液的再生。用Fe2(SO4)3吸收液脱除H2S经历以下三步:
Ⅰ:H2S(g)⇌H2S(aq)ΔH<0
Ⅱ:H2S(aq)⇌H+(aq)+HS-(aq)
Ⅲ:HS-(aq)+2Fe3+(aq)═S(s)↓+2Fe2+(aq)+H+(aq)
①步骤ⅠH2S(g)⇌H2S(aq)在(填“高温下”“低温下”或“任何条件下”)有利于自发进行。
②第Ⅱ步的电离平衡常数的表达式为。
③反应后的溶液在硫杆菌的作用下进行的再生反应为4FeSO4+O2+2H2SO42Fe2(SO4)3+2H2O。该反应中每消耗标准状况下11.2LO2,可以再生出硫杆菌molFe2(SO4)3。该再生反应(填“能”或“不能”)在高温下进行,理由是。
(2)CO2的大量排放会加剧温室效应,实现CO2的资源化利用不但能有效减少CO2排放,还可以变废为宝。CO2催化加氢合成二甲醚是一种CO2转化方法,转化过程中主要发生下列反应:
反应Ⅰ:CO2(g)+H2(g)⇌CO(g)+H2O(g)ΔH1═+41.2kJ•mol-1
反应Ⅱ:2CO2(g)+6H2(g)═CH3OCH3(g)+3H2O(g)ΔH2═-122.5kJ•mol-1
①2CO(g)+4H2(g)⇌CH3OCH3(g)+H2O(g)ΔH3═kJ•mol-1。
②在一压强为170kPa的恒压密闭容器中充入1molCO2和1mol H2发生反应Ⅰ、Ⅱ,CO2平衡转化率和平衡时CH3OCH3的选择性(CH3OCH3的选择性═×100%)随温度的变化如图。2×CH3OCH3的物质的量反应的CO2的物质的量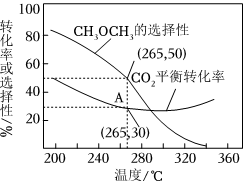
计算A点时H2(g)的转化率为%,此温度下反应Ⅰ的分压(分压═物质的量分数×总压)平衡常数Kp═(保留一位有效数字)。组卷:23引用:2难度:0.5


