鲁科版(2019)选择性必修1《第3章 物质在水溶液中的行为》2023年单元测试卷(11)
发布:2024/8/17 0:0:1
一、选择题
-
1.下列曲线中,可以描述乙酸(甲,Ka=1.8×10-5)和一氯乙酸(乙,Ka=1.4×10-3)在 水中的电离度与浓度关系的是( )
组卷:92引用:5难度:0.7 -
2.下列示意图中,正确的是( )
组卷:0引用:2难度:0.5 -
3.关于常温下pH为2的盐酸,下列叙述正确的是( )
组卷:36引用:4难度:0.7 -
4.下列各组离子在溶液中一定能大量共存的是( )
组卷:11引用:3难度:0.6 -
5.下列各项实验中,根据实验操作和现象所得出的结论正确的是( )
选项 实验操作 现象 结论 A 将金属片a、b插入稀硫酸中,用导线将它们相连 a上产生气泡 金属活动性:a>b B 相同条件下,等体积、等pH的HA和HB两种酸分别与足量的Zn反应 反应完全后,HA溶液产生的H2多 酸性:HA>HB C 向浓度均为0.1mol/L的BaCl2和CaCl2混合液中滴加Na2SO4溶液 出现白色沉淀 Ksp(BaSO4)<Ksp(CaSO4) D 将充满NO2气体的密闭玻璃球浸泡在热水中 玻璃球中红棕色加深 反应2NO2(g)⇌N2O4(g)ΔH<0 组卷:8引用:2难度:0.5 -
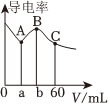 6.常温下,CH3COOH和NH3•H2O的电离常数均为1.8×10-5。向20mL浓度均为0.1mol/LNaOH和NH3•H2O的混合液中滴加等物质的量浓度的CH3COOH溶液,所得混合液的导电率与加入CH3COOH溶液的体积(V)的关系如图所示。下列说法不正确的是( )组卷:10引用:4难度:0.6
6.常温下,CH3COOH和NH3•H2O的电离常数均为1.8×10-5。向20mL浓度均为0.1mol/LNaOH和NH3•H2O的混合液中滴加等物质的量浓度的CH3COOH溶液,所得混合液的导电率与加入CH3COOH溶液的体积(V)的关系如图所示。下列说法不正确的是( )组卷:10引用:4难度:0.6
四、解答题
-
19.金属氢氧化物在酸中溶解度不同,因此可以利用这一性质,控制溶液pH,达到分离金属离子的目的。难溶金属的氢氧化物在不同pH下的溶解度(S/mol•L-1)如图所示。
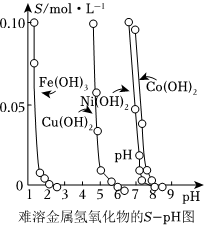
(1)pH=3时溶液中铜元素的主要存在形式是。
(2)若要除去CuCl2溶液中的少量Fe3+,应该控制溶液pH范围在。
A.<1
B.4左右
C.>6
(3)在Ni(NO3)2溶液中含有少量的Co2+杂质,(填“能”或“不能”)通过调节溶液pH的方法来除去,理由是。
(4)已知一些难溶物的溶度积常数如表。
为除去某工业废水中含有的Cu2+、Pb2+、Hg2+杂质,最适宜向此工业废水中加入过量的物质 FeS MnS CuS PbS HgS ZnS Ksp 6.3×10-18 2.5×10-13 1.3×10-35 3.4×10-28 6.4×10-33 1.6×10-24 (填选项)。
A.NaOH
B.FeS
C.Na2S
(5)已知25℃时,Ksp[Mg(OH)2]=5.6×10-12,Ksp[Cu(OH)2]=2.2×10-20。在25℃时,向浓度均为0.1mol•L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成(填化学式)沉淀。
(6)已知25℃时,Ksp[Fe(OH)3]=2.6×10-39,该温度下反应Fe(OH)3+3H+⇌Fe3++3H2O的平衡常数K=。
(7)优化反应条件是研究化学反应的重要方向。以硫代硫酸钠与硫酸的反应Na2S2O3+H2SO4═Na2SO4+SO2↑+S↓+2H2O为例,探究外界条件对化学反应速率的影响,实验方案如表所示。
表中,a为实验序号 Na2S2O3溶液 H2SO4溶液 蒸馏水 温度/℃ 浓度/(mol/L) 体积/mL 浓度/(mol/L) 体积/mL 体积/mL Ⅰ 0.1 1.5 0.1 1.5 10 20 Ⅱ 0.1 2.5 0.1 1.5 9 a Ⅲ 0.1 b 0.1 1.5 9 30 ,b为。实验表明,实验Ⅲ的反应速率最快,支持这一结论的实验现象为。组卷:42引用:6难度:0.6 -
 20.氮的化合物在国防建设、工农业生产和生活中有广泛的用途。请回答下列问题:
20.氮的化合物在国防建设、工农业生产和生活中有广泛的用途。请回答下列问题:
(1)已知25℃,NH3•H2O的Kb=1.8×10-5,H2SO3的Ka1=1.3×10-2,Ka2=6.2×10-8。
①若氨水的浓度为2.0mol•L-1,溶液中的c(OH-)=mol•L-1。
②将SO2通入2.0mol•L-1氨水中(溶液的体积保持不变),当c(OH-)降至1.0×10-7mol•L-1时,溶液中的c(SO32-)/c(HSO3-)=;(NH4)2SO3溶液中的质子守恒。
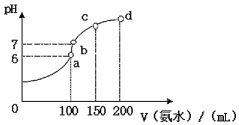
(2)室温时,向100mL 0.1mol•L-1HCl溶液中滴加0.1mol•L-1氨水,得到溶液pH与氨水体积的关系曲线如图所示:
①试分析图中a、b、c、d四个点,水的电离程度最大的是;
②在b点,溶液中各离子浓度由大到小的排列顺序是;
③写出a点混合溶液中下列算式的精确结果(不能近似计算):c(Cl-)-c(NH4+)=,c(H+)-c(NH3•H2O)=;
(3)亚硝酸(HNO2)的性质和硝酸类似,但它是一种弱酸。常温下亚硝酸的电离平衡常数Ka=5.1×10-4;H2CO3的Ka1=4.4×10-7,Ka2=4.7×10-11.常温下向含有2mol碳酸钠的溶液中加入含1mol HNO2的溶液后,溶液中CO32-、HCO3-和NO2-的浓度由大到小的顺序是。组卷:44引用:2难度:0.5


