 氮的化合物在国防建设、工农业生产和生活中有广泛的用途。请回答下列问题:
氮的化合物在国防建设、工农业生产和生活中有广泛的用途。请回答下列问题:
(1)已知25℃,NH3•H2O的Kb=1.8×10-5,H2SO3的Ka1=1.3×10-2,Ka2=6.2×10-8。
①若氨水的浓度为2.0mol•L-1,溶液中的c(OH-)=0.6×10-20.6×10-2mol•L-1。
②将SO2通入2.0mol•L-1氨水中(溶液的体积保持不变),当c(OH-)降至1.0×10-7mol•L-1时,溶液中的c(SO32-)/c(HSO3-)=0.620.62;(NH4)2SO3溶液中的质子守恒c(H+)+c(HSO3-)+2c(H2SO3)═c(NH3•H2O)+c(OH-)c(H+)+c(HSO3-)+2c(H2SO3)═c(NH3•H2O)+c(OH-)。
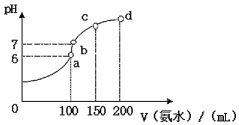
(2)室温时,向100mL 0.1mol•L-1HCl溶液中滴加0.1mol•L-1氨水,得到溶液pH与氨水体积的关系曲线如图所示:
①试分析图中a、b、c、d四个点,水的电离程度最大的是aa;
②在b点,溶液中各离子浓度由大到小的排列顺序是c(Cl-)=c(NH4+)>c(OH-)=c(H+)c(Cl-)=c(NH4+)>c(OH-)=c(H+);
③写出a点混合溶液中下列算式的精确结果(不能近似计算):c(Cl-)-c(NH4+)=(10-6-10-8)mol/L(10-6-10-8)mol/L,c(H+)-c(NH3•H2O)=10-8mol/L10-8mol/L;
(3)亚硝酸(HNO2)的性质和硝酸类似,但它是一种弱酸。常温下亚硝酸的电离平衡常数Ka=5.1×10-4;H2CO3的Ka1=4.4×10-7,Ka2=4.7×10-11.常温下向含有2mol碳酸钠的溶液中加入含1mol HNO2的溶液后,溶液中CO32-、HCO3-和NO2-的浓度由大到小的顺序是c(HCO3-)>c(NO2-)>c(CO32-)c(HCO3-)>c(NO2-)>c(CO32-)。
【考点】离子浓度大小的比较.
【答案】0.6×10-2;0.62;c(H+)+c(HSO3-)+2c(H2SO3)═c(NH3•H2O)+c(OH-);a;c(Cl-)=c(NH4+)>c(OH-)=c(H+);(10-6-10-8)mol/L;10-8mol/L;c(HCO3-)>c(NO2-)>c(CO32-)
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/8/17 0:0:1组卷:44引用:2难度:0.5


