人教版(2019)选择性必修1《1.2.2 反应热的计算》2023年同步练习卷
发布:2024/8/16 20:0:2
一、选择题
-
1.已知下列热化学反应方程式:
①Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H=-25kJ•mol-1
②3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g)△H=-47kJ•mol-1
③Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)△H=19kJ•mol-1.
则FeO(s)被CO(g)还原成Fe(s)和CO2(g)的热化学方程式为( )组卷:20引用:2难度:0.9 -
2.“长征三号”丙运载火箭推进器常以联氨(N2H4)为燃料、过氧化氢为助燃剂.已知下列各物质反应的热化学方程式为:则联氨与过氧化氢反应的热化学方程式可表示为( )
N2H4(g)+O2(g)═N2(g)+2H2O(g)△H1=-533.23kJ•mol-1
H2O(g)═H2O(l)△H2=-44kJ•mol-1
2H2O2(l)═2H2O(l)+O2(g)△H3=-196.4kJ•mol-1.组卷:15引用:3难度:0.7 -
3.已知EH-H=436kJ•mol-1,ECl-Cl=243kJ•mol-1,EH-Cl=431kJ•mol-1,则热化学方程式H2(g)+Cl2(g)═2HCl(g)△H=-QkJ•mol-1中 Q等于( )
组卷:3引用:2难度:0.8 -
4.工业上高纯硅可通过反应:SiCl4(g)+2H2(g)
Si(s)+4HCl(g)制取,该反应的ΔH为( )高温化学键 Si-O Si-Cl H-H H-Cl Si-Si Si-C 键能/kJ•mol-1 460 360 436 431 176 347 组卷:19引用:3难度:0.5
四、解答题
-
13.合成氨是人类科学技术发展史上的一项重大成就,是化学和技术对社会发展与进步的巨大贡献之一,其反应原理为:N2(g)+3H2(g)⇌2NH3(g)ΔH=-92kJ/mol。
(1)已知下列数据:
则N-H键的键能是化学键 H-H N≡N 键能(kJ/mol) 436 946 kJ/mol。
(2)T℃时,在2L的密闭容器中发生上述合成氨反应,开始投入1molH2和一定量的N2,体系中n(N2)随时间的变化如下表:
①用H2表示从0~2min内该反应的平均速率v(H2)=时间(min) 0 1 2 3 4 5 N2的物质的量(mol) 0.40 0.20 0.14 0.12 0.12 0.12 。
②第4min时NH3的体积分数为。(保留三位有效数字)
③下列叙述中能说明上述反应达到平衡状态的是。(用字母表示)
a.该条件下生成0.3molH2同时生成0.2molNH3
b.该条件下气体的平均相对分子质量保持不变
c.该条件下混合气体的密度保持不变
d.c(N2):c(H2):c(NH3)=1:3:2组卷:18引用:2难度:0.5 -
14.热力学标准状况(298.15K、101kPa)下,由稳定单质发生反应生成1mol 化合物的反应热叫该化合物的生成热(ΔH)。图甲为ⅥA族元素氢化物a、b、c、d的生成热数据示意图。试完成下列问题。
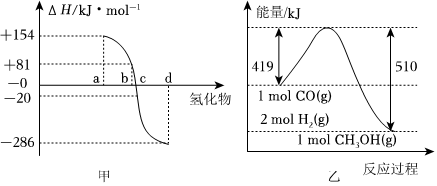
(1)①请你归纳非金属元素氢化物的稳定性与氢化物的生成热ΔH的关系:。
②硒化氢在上述条件下发生分解反应的热化学方程式为。
(2)在25℃、101kPa下,已知SiH4气体在氧气中完全燃烧后恢复至原状态,平均每转移1mol电子放热190kJ,该反应的热化学方程式是
(3)根据图乙写出反应CO(g)+2H2(g)═CH3OH(g)的热化学方程式:。
(4)由金红石(TiO2)制取单质Ti的步骤为:Ti2→TiCl4Ti800℃、ArMg
已知:
Ⅰ.C(s)+O2(g)═CO2(g)ΔH=-393.5kJ•mol-1
Ⅱ.2CO(g)+O2(g)═2CO2(g)ΔH=-566kJ•mol-1
Ⅲ.TiO2(s)+2Cl2(g)═TiCl4(s)+O2(g)ΔH=+141kJ•mol-1
①TiO2(s)+2Cl2(g)+2C(s)═TiCl4(s)+2CO(g)的ΔH=。
②反应TiCl4+2Mg2MgCl2+Ti在Ar气氛中进行的理由是800℃。组卷:20引用:5难度:0.7


