2022-2023学年广东省广州市培正中学高二(上)第一次段考化学试卷
发布:2024/9/14 1:0:8
一、单项选择题。本题共有20小题,每题3分,共60分。
-
1.在气体反应体系中,能使反应物中活化分子数和活化分子百分数同时增加的方法是( )
①增大反应物浓度
②升高温度
③增大压强
④加入催化剂组卷:14引用:2难度:0.8 -
2.一定温度下,对于可逆反应N2(g)+3H2(g)⇌2NH3(g)(正反应放热)的下列叙述,不能说明反应已达化学平衡状态的是( )
组卷:10引用:1难度:0.6 -
3.25℃和1.01×105Pa时,2N2O5(g)═4NO2(g)+O2(g)ΔH=+56.76kJ/mol,该反应能自发进行的原因是( )
组卷:78引用:7难度:0.8 -
 4.由N2O和NO反应生成N2和NO2的能量变化如图所示。下列说法正确的是( )组卷:76引用:4难度:0.5
4.由N2O和NO反应生成N2和NO2的能量变化如图所示。下列说法正确的是( )组卷:76引用:4难度:0.5 -
5.已知450℃时,反应H2(g)+I2(g)⇌2HI(g)的K=50,由此推测在450℃时,反应 2HI(g)⇌H2(g)+I2(g)的化学平衡常数为( )
组卷:246引用:86难度:0.9 -
6.某小组用25.00mL0.50mol/NaOH溶液和25.00mL0.50mol/L硫酸溶液进行反应热的测定,实验测得中和热的ΔH=-53.5kJ/mol。该值与理论值产生偏差的原因不可能是( )
组卷:44引用:5难度:0.7 -
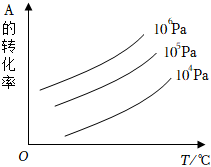 7.有一化学平衡mA(g)+nB(g)⇌pC(g)+qD(g),如图表示的是A的转化率与压强、温度的关系。下列叙述正确的是( )组卷:737引用:34难度:0.7
7.有一化学平衡mA(g)+nB(g)⇌pC(g)+qD(g),如图表示的是A的转化率与压强、温度的关系。下列叙述正确的是( )组卷:737引用:34难度:0.7
二、填空题,共3题,总分40分。
-
 22.氨有广泛的用途,可用于制造化肥、硝酸等工业产品。
22.氨有广泛的用途,可用于制造化肥、硝酸等工业产品。
已知合成氨的反应为:N2(g)+3H2(g)⇌2NH3(g)ΔH=-92.4kJ•mol-1
在2.0L的恒容密闭容器中,充入0.8molN2、1.6molH2和固体催化剂进行合成。
(1)在不同温度下达到平衡时测得NH3的体积分数如表所示:
试比较a1、a2的大小:a1T/℃ 200 300 400 NH3的体积分数 a1 a2 25% a2 (填“>”、“<”或“=”)。
(2)合成氨的反应在一定温度下达到平衡,此时NH3的体积分数为20%。求此温度下反应2NH3(g)⇌N2(g)+3H2(g)的平衡常数K(写出计算过程)。。
(3)以CO2和NH3为原料生产尿素[化学式为:CO(NH2)2]的主要反应如下:
①2NH3(g)+CO2(g)═NH2CO2NH4(s) ΔH1=-159.47kJ•mol-1
②NH2CO2NH4(s)═CO(NH2)2(s)+H2O(g) ΔH2=+72.49kJ•mol1
写出以CO2和NH3为原料生产CO(NH2)2 的热化学方程式:。
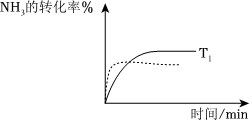
(4)氨催化氧化制硝酸中的主要反应为:4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g)ΔH<0。在温度T1时NH3的转化率随反应时间(t)的变化如图所示。其他条件不变,仅改变温度为T2(T2>T1)。请在图中画出NH3的转化率随反应时间变化的预期结果示意图,并进行必要标注。。组卷:4引用:1难度:0.6 -
 23.I.一定温度下,在2L的密闭容器中,X、Y、Z三种气体的量随时间变化的曲线如图:
23.I.一定温度下,在2L的密闭容器中,X、Y、Z三种气体的量随时间变化的曲线如图:
(1)从反应开始到10s时,用Z表示的反应速率为,X的物质的量浓度减少了,Y的转化率为。
(2)该反应的化学方程式为。
Ⅱ.KI溶液在酸性条件下能与氧气反应。现有以下实验记录:回答下列问题:
(1)该反应的离子方程式为实验编号 ① ② ③ ④ ⑤ 温度/℃ 30 40 50 60 70 显色时间/s 160 80 40 20 10 。
(2)该实验的目的是探究。
(3)实验试剂除了1mol•L-1KI溶液、0.1mol•L-1H2SO4溶液外,还需要的试剂是;
(4)上述实验操作中除了需要(3)的条件外,还必须控制不变的是(填字母)。
A.温度
B.试剂的浓度
C.试剂的用量(体积)
D.试剂添加的顺序组卷:18引用:3难度:0.6


