2022-2023学年北京二中高二(上)月考化学试卷(11月份)
发布:2024/9/14 10:0:8
一.选择题(每小题只有一个正确答案,每小题2分,共50分)
-
1.下列物质属于弱电解质的是( )
组卷:177引用:8难度:0.6 -
2.下列反应中,属于吸热反应的是( )
组卷:38引用:3难度:0.9 -
3.下列因素不可能影响化学平衡移动的是( )
组卷:17引用:6难度:0.6 -
4.某原电池总反应为:Cu+2Fe3+═Cu2++2Fe2+,下列能实现该反应的原电池是( )
A B C D 电极材料 Cu、Zn Cu、Ag Cu、C Fe、Zn 电解液 FeCl3 Fe2(SO4)3 Fe(NO3)2 CuSO4 组卷:173引用:18难度:0.9 -
5.下列物质的溶液在蒸发皿中加热蒸干并灼烧,可以得到该物质的是( )
组卷:64引用:6难度:0.9 -
6.在以下各种情形下,方程式的书写正确的是( )
组卷:39引用:2难度:0.7 -
7.化学与生产、生活密切相关,下列事实与盐类水解无关的是( )
组卷:85引用:2难度:0.7 -
8.在氨水中,存在着电离平衡:NH3•H2O⇌NH4++OH-。下列说法正确的是( )
组卷:30引用:3难度:0.5 -
9.下列说法中,可以证明醋酸是弱电解质的是( )
组卷:4引用:1难度:0.6
二.非选择题(共50分;请将答案填写在答题纸上)
-
28.某工厂利用制革工业污泥[含Cr(Ⅲ)]制取CrOH(H2O)5SO4的工艺流程如图1所示:
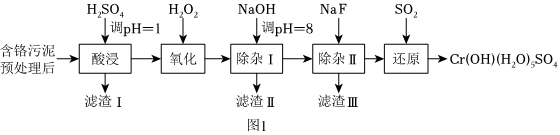
已知:酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+等。
(1)酸浸时,为了提高浸取率可采取的措施有。
(2)H2O2的作用是将滤液中的Cr3+转化为Cr2,控制其他条件不变,在相同时间内,测得温度对Cr3+转化率的影响如图2所示。请分析温度超过70℃时,Cr3+转化率下降的原因是O2-7。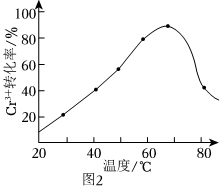
(3)常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
①滤渣Ⅱ的主要成分为阳离子 Fe3+ Al3+ Mg2+ Ca2+ 开始沉淀时的pH 1.5 3.4 8.9 11.9 沉淀完全时的pH 2.8 4.7(>8溶解) 10.9 14 (填化学式)。
②用NaOH调节溶液的pH不能超过8,其理由是。
(4)在“除杂Ⅱ”中,当溶液中镁离子和钙离子沉淀完全时,所得溶液中=c(Ca2+)c(Mg2+)。(已知:Ksp(CaF2)=1.48×10-10,Ksp(MgF2)=7.40×10-11)
(5)上述流程中,加入NaOH溶液后,溶液呈碱性,Cr2转化为O2-7,写出上述流程中的“还原”过程生成CrOH(H2O)5SO4沉淀的离子方程式CrO2-4。组卷:0引用:2难度:0.7 -
29.某小组探究Na2SO3溶液和KIO3溶液的反应。
实验Ⅰ:向某浓度的KIO3酸性溶液(过量)中加入Na2SO3溶液(含淀粉),一段时间(t秒)后,溶液突然变蓝。(资料:在酸性溶液氧化I-,反应为IO-3+5I-+6H+═3I2+3H2O)IO-3
(1)溶液变蓝,说明Na2SO3具有性。
(2)针对t秒前溶液未变蓝,小组做出如下假设:
ⅰ.t秒前未生成I2,是由于反应的活化能(填“大”或“小”),反应速率慢导致的。
ⅱ.t秒前生成了I2,但由于存在Na2SO3,(用离子方程式表示),I2被消耗。
(3)下述实验证实了假设ⅱ合理。
实验Ⅱ:向实验Ⅰ的蓝色溶液中加入,蓝色迅速消失,后再次变蓝。
(4)进一步研究Na2SO3溶液和KIO3溶液反应的过程,装置如图。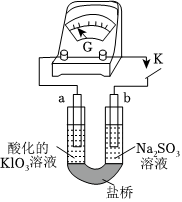
实验Ⅲ:K闭合后,电流表的指针偏转情况记录如下表:
①K闭合后,取b极区溶液加入盐酸酸化的BaCl2溶液,生成白色沉淀,则b极上的电极反应为表盘 
时间/min 0~t1 t2~t3 t4 偏转位置 右偏至Y 指针回到“0”处,又返至“X”处;如此周期性往复多次•••••• 指针归零 。
②0~t1时,从a极区取溶液于试管中,滴加淀粉溶液,溶液变蓝;直接向a极区滴加淀粉溶液,溶液未变蓝。判断在a极放电的产物是IO-3。
③结合反应解释t2~t3时指针回到“0”处的原因:。
(5)综合实验Ⅰ、Ⅱ、Ⅲ,下列说法正确的是。
A.对比实验Ⅰ、Ⅱ,t秒后溶液变蓝,Ⅰ中被完全氧化SO2-3
B.对比实验Ⅰ、Ⅲ,t秒前未发生反应IO-3
C.实验Ⅲ中指针返回X处的原因,可能是I2氧化SO2-3组卷:4引用:2难度:0.6


