2022-2023学年黑龙江西北八校联合体高二(上)第一次月考化学试卷
发布:2024/9/20 2:0:8
一、选择题:本题共10个小题,每小题2分,共20分.在每小题给出的四个选项中,只有一项是符合题目要求的.
-
1.下列有关测定中和反应反应热实验的说法正确的是( )
组卷:35引用:3难度:0.8 -
2.勒夏特列原理是平衡移动问题的指挥棒,下列事实不能用勒夏特列原理解释的是( )
组卷:13引用:3难度:0.7 -
3.只知某反应向正反应方向移动,下列说法不正确的是( )
①反应物转化率必定增加;②生成物的浓度必定增加;③反应物的浓度必定降低;④生成物的质量必定减少。组卷:12引用:4难度:0.6 -
4.在一密闭容器中进行如下反应:2SO2(g)+O2(g)⇌2SO3(g),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2mol/L、0.1mol/L、0.2mol/L,当反应达平衡时,可能存在的数据是( )
组卷:120引用:4难度:0.7 -
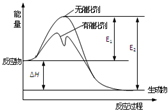 5.2SO2(g)+O2(g)⇌2SO3(g)反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能).下列有关叙述正确的是( )组卷:41引用:7难度:0.7
5.2SO2(g)+O2(g)⇌2SO3(g)反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能).下列有关叙述正确的是( )组卷:41引用:7难度:0.7 -
6.实验室用Zn粒与稀盐酸反应制备H2时反应速率太慢,为了加快反应速率,下列方法可行的是( )
组卷:18引用:5难度:0.5 -
7.某科研机构提出的碘硫热化学循环是由Ⅰ、Ⅱ、Ⅲ三步反应组成的(如图所示),下列有关说法正确的是( )
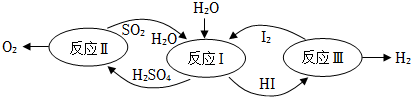 组卷:1引用:1难度:0.7
组卷:1引用:1难度:0.7
三、非选择题共50分,
-
22.Ⅰ、大气中的二氧化碳主要来自煤、石油及其他含碳化合物的燃烧。已知25℃时,101kPa下,相关物质燃烧的热化学方程式知下:
①C(石墨,s)+O2(g)=CO2(g) ΔH=-393.5kJ•mol-1;
②C(石墨,s)+O2(g)=CO(g) ΔH=-110.5kJ•mol-1。12
(1)3.6g石墨在6.4g氧气中燃烧至反应物均耗尽:
①燃烧后的产物为(填化学式),转移的电子总物质的量为mol。
②燃烧后放出的总热量为kJ。
③将所得气体通入750mL0.2mol•L-1KOH溶液中充分反应(不考虑气体的逸出),所得的盐为(填化学式),判断的依据是。
④若测得③中反应放出的总热敏为mkJ,已知该条件下,将44gCO2,通入1L2mol•L-1KOH溶液中充分反应放出nkJ的热量。则CO2与KOH溶液反应生成KHCO3的热化学方程式为(用含m、n的式子表示)。
(2)已知:C(金刚石,s)+O2(g)=CO2(g) ΔH=-395.4kJ•mol-1,下列说法正确的是(填标号)。
A.金刚石比石墨稳定
B.每放出39.54kJ的热量,需消耗氧气的体积为2.24L
C.等物质的量的金刚石和石墨,完全燃烧后,石墨放出的热量更少
Ⅱ、(3)在一定温度,101kPa下,分别在1L密闭容器中充入2mol N2O和2mol CO,发生反应:CO(g)+N2O(g)⇌CO2(g)+N2(g),达平衡时,测得无毒气体的体积分数75%,该条件下平衡常数Kp=(Kp为以分压表示的平衡常数,分压-总压×物质的量分数)。组卷:1引用:2难度:0.5 -
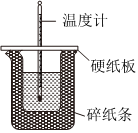 23.取0.55mol•L-1的NaOH溶液50mL与0.25mol•L-1的硫酸溶液50mL置于如图所示的装置中进行中和反应反应热的测定实验:
23.取0.55mol•L-1的NaOH溶液50mL与0.25mol•L-1的硫酸溶液50mL置于如图所示的装置中进行中和反应反应热的测定实验:
回答下列问题:温度 起始温度(t1)/℃ 终止温度(t2)℃ 实验次数 H2SO4 NaOH 平均值 1 26.2 26.0 26.1 29.5 2 27.0 27.4 27.2 32.3 3 25.9 25.9 25.9 29.2 4 26.4 26.2 26.3 29.8
(1)从图中实验装置看,其中尚缺少的一种玻璃仪器是。
(2)实验中若用70mL0.25mol•L-1H2SO4溶液跟50mL0.55mol•L-1NaOH溶液反应,与上述实验相比,所放出的热量(填“相等”或“不相等”),所求中和热(填“相等”或“不相等”)。
(3)若0.55mol•L-1NaOH溶液和0.25mol•L-1硫酸溶液的密度都是1g•cm-3,反应后生成的溶液比热容c=4.18J/(g•℃),通过以上数据计算中和反应反应热ΔH=(结果保留小数点后1位)。
(4)现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和1L1mol/L的稀盐酸恰好完全反应,其反应热分别为ΔH1、ΔH2、ΔH3,则ΔH1、ΔH2、ΔH3的大小关系为。
(5)现将浓度相等、体积分别为V1、V2的H2SO4、NaOH溶液混合,测量混合液温度,结果如图(已知:V1+V2=60mL)。下列叙述正确的是。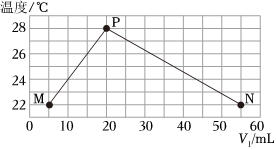
A.实验的环境温度为22℃
B.P点混合溶液呈中性
C.由M、P点温差计算可得到中和热为53.7kJ
D.若将H2SO4改为CH3COOH,P点将向右下方移动
(6)中和热测定实验中,下列操作能保证实验准确性的是(填字母)。
a.为节省时间,只做一次实验
b.两烧杯夹层间碎纸条没有填满
c.记录混合液的最高温度作为终止温度
d.用铁制容器代替烧杯进行实验
e.测量HCl溶液的温度计用水洗净擦干后才测NaOH溶液的温度组卷:15引用:2难度:0.7


