2022-2023学年广东省广州市白云中学高一(下)期中化学试卷
发布:2024/5/15 8:0:8
一、选择题(1-10题每题2分,11-16每题4分,共44分。)
-
1.十八大以来,我国科学技术迅猛发展。下列设备工作时,将化学能转化为电能的是( )




A.太阳能集热器 B.风力发电机 C.偏二甲肼燃烧 D.锂离子电池 组卷:59引用:6难度:0.6 -
2.硅及其化合物与科学、技术,社会,环境密切相关。下列有关说法不正确的是( )
组卷:72引用:4难度:0.6 -
3.下列反应中,酸体现还原性的是( )
组卷:85引用:8难度:0.7 -
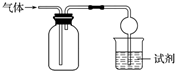 4.如图所示装置可用于收集SO2并验证其某些化学性质,下列说法正确的是( )
4.如图所示装置可用于收集SO2并验证其某些化学性质,下列说法正确的是( ) 选项 试剂 现象 结论 A 酸性KMnO4溶液 溶液褪色 SO2有氧化性 B 品红溶液 溶液褪色 SO2有漂白性 C NaOH溶液 无明显现象 SO2与NaOH溶液不反应 D 溴水 溶液褪色 SO2有漂白性 组卷:88引用:3难度:0.7 -
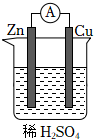 5.关于如图所示的原电池,下列说法正确的是( )组卷:79引用:6难度:0.8
5.关于如图所示的原电池,下列说法正确的是( )组卷:79引用:6难度:0.8 -
6.除去粗盐中的杂质MgCl2、CaCl2和Na2SO4,过程如图:

下列有关说法中,不正确的是( )组卷:71引用:5难度:0.7
一、选择题(1-10题每题2分,11-16每题4分,共44分。)
-
19.Ⅰ.在2L的恒容密闭容器中充入1molCO和2molH2,一定条件下发生反应:CO(g)+2H2(g)⇌CH3OH(g),测得CO和CH3OH(g)的物质的量变化如图1所示,反应过程中的能量变化如图2所示。
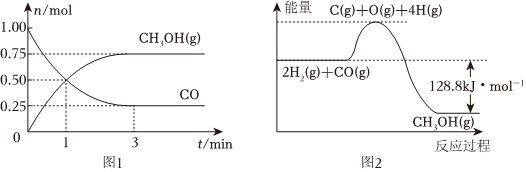
(1)从反应开始至达到平衡,以H2表示反应的平均反应速率v(H2)=。
(2)下列措施能增大反应速率的是(填字母)。
A.升高温度
B.降低压强
C.减小CH3OH的浓度
D.加入合适的催化剂
(3)平衡时CO的转化率为。
(4)已知断开1molCO(g)和2molH2(g)中的化学键需要吸收的能量为1924kJ,则断开1molCH3OH(g)中的所有化学键所需要吸收kJ的能量。
Ⅱ.燃料电池是利用燃料与氧乞反应从而将化学能转化为电能的装置,以葡萄糖为燃料的微生物燃料电池结构示意图如图所示。注:电解质为稀硫酸;质子交换膜只通过H+。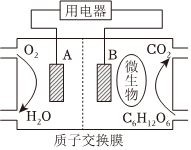
葡萄糖与氧气反应的化学方程式为C6H12O6+6O2=6CO2+6H2O。
(5)B为生物燃料电池的(填“正”或“负”)极。
(6)正极反应式为。
(7)在电池反应中,每消耗1mol氧气,理论上生成标准状况下二氧化碳的体积是。组卷:49引用:1难度:0.6 -
20.在化学反应的研究和实际应用中,人们除了选择合适的化学反应以实现新期特的物质转化或能量转化,还要关注化学反应进行的快慢和程度,以提高生产效率。
(1)控制条件,让反应在恒容密闭容器中进行如下反应:2NO(g)+2CO(g)⇌N2(g)+2CO2(g)。用传感器测得不同时间NO和CO的浓度如表。
前2s内的平均反应速率v(N2)=时间/s 0 1 2 3 4 5 c(NO)/(10-4mol/L) 10.0 4.50 2.50 1.50 1.00 1.00 c(CO)/(10-3mol/L) 3.60 3.05 2.85 2.75 2.70 2.70 ,从表格看,已达化学平衡的时间段为:。
(2)如图是在一定温度下,某固定容积的密闭容器中充入一定量的NO2气体后,发生反应2NO2⇌N2O4,已知NO2是红棕色气体,N2O4是无色气体。反应速率(v)与时间(t)的关系曲线。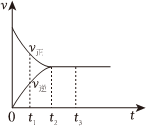
下列叙述正确的是。
a.t1时,反应未达到平衡,NO2浓度在减小
b.t2时,反应达到平衡,反应不再进行
c.t2~t3各物质浓度不再变化
d.t2~t3各物质浓度相等
e.0~t2,N2O4浓度增大
f.反应过程中气体的颜色不变
(3)在压强为0.1MPa条件下,amolCO与3amolH2的混合气体在催化剂作用下能自发放热反应生成甲醇:CO(g)+2H2(g)⇌CH3OH(l)。为了寻得合成甲醇的适宜温度与压强,某同学设计了三组实验,部分实验条件已经填在下面的实验设计表中。表中剩余的实验数据:n=,m=。
(4)比较相同浓度的Na2S2O3溶液和不同浓度的H2SO4溶液反应的反应快慢可通过测定实验编号 T(℃) n(CO):n(H2) P(MPa) ① 180 2:3 0.1 ② n 2:3 5 ③ 350 m 5 来实现。
(5)在四个不同的容器中,在不同的条件下进行合成氨反应:N2+3H2⇌2NH3。根据在相同时间内测定的结果判断,生成氨气的反应速率由大到小排列。
A.v(H2)=0.6mol/(L•min)
B.v(N2)=0.3mol/(L•min)
C.v(NH3)=0.15mol/(L•min)
D.v(H2)=0.3mol/(L•min)组卷:37引用:1难度:0.6


