2023年江苏省盐城市亭湖区盐城景山中学中考化学三模试卷
发布:2024/5/24 8:0:9
一、选择题(本大题共13小题,每小题2分,共30分)。
-
1.2023年4月22日是第54个“世界地球日”,下列认识不正确的是( )
组卷:35引用:2难度:0.8 -
2.“玉粽袭香千舸竞,艾叶黄酒可驱邪”。下列端午活动中涉及化学变化的是( )
组卷:60引用:5难度:0.8 -
3.下列实验操作正确的是( )
组卷:4引用:2难度:0.7 -
4.“上善若水,水善利万物而不争。”下列有关水的说法错误的是( )
组卷:1引用:2难度:0.6 -
5.下列化学用语书写正确的是( )
组卷:41引用:2难度:0.7
二、非选择题(本题共4小题,共40分)
-
18.金属在人类生产中的应用十分广泛。
(1)三星堆遗址的Ⅱ号青铜神树引人注目,铸造铜树时,在铜中加入锡和铅会使材料的熔点(选填“降低”、“升高”)。
(2)如图为锌与硫酸镍和硫酸锰混合溶液充分反应后粒子变化微观示意图。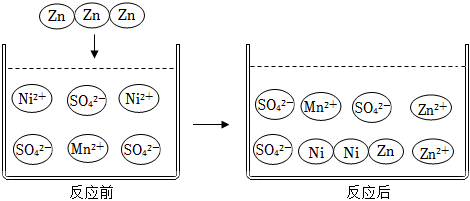
①Ni、Zn、Mn三种金属活动性由强到弱的顺序。
②反应后溶液的质量会(填“增大”或“减小”)。
(3)化学小组的同学收集到一些含硝酸银、硝酸铜的混合废液,同学们向其中加入一定量锌粉,反应停止后过滤,滤液仍为蓝色。则下列有关判断正确的是(填字母)。
A.滤渣中一定有银,没有铜和锌
B.滤渣中一定有银和锌,可能有铜
C.滤液中一定有硝酸锌、硝酸铜、硝酸银
D.滤液中一定有硝酸锌、硝酸铜,可能有硝酸银
(4)2022年全国钢铁产量高达10亿多万吨。铁的冶炼是化学研究的重要范畴。取12gFe2O3粉末,小组同学用如图装置模拟炼铁,并测定反应后固体的成分。
资料:CH4具有还原性,能与Fe2O3反应生成CO2、H2O和铁单质或铁的氧化物。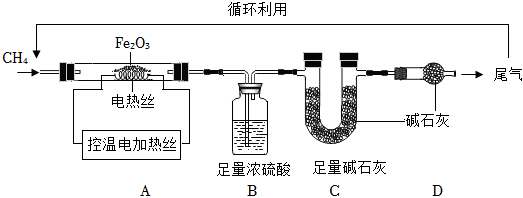
a.连接装置,先,再装入药品
b.反应中循环使用CH4的目的是。
c.若生成物充分被B、C装置吸收,B、C装置增加的质量比为。
d.控温加热一段时间后,继续通CH4至冷却,称得A中剩余固体为8.8g,若固体成分为Fe和FeO,则剩余固体中FeO的质量为g。
(5)2023年4月24日是第八个“中国航天日”。神舟十五号飞船成功发射,实现了“格物致知,叩问苍穹”的航空主题。
a.飞船进入太空后,白天太阳能电池板打开给电池充电,储存能量,夜间利用电池能量运行,电池在该过程中的能量转化形式为:太阳能→→电能。
b.飞船返回舱使用了钛合金等复合金属材料制成的“避火衣”,钛合金中的钛(Ti),一般用过量的镁在加热的条件下与TiCl4反应制得金属钛,发生反应的化学方程式为。组卷:107引用:2难度:0.5 -
19.碳酸钠俗称纯碱,是重要的化工原料之一。
Ⅰ、碳酸钠的获得
(1)纯碱可以从内陆盐湖中提取。获得粗碱中含氯化钠和泥沙等少量杂质,初步提纯流程如下: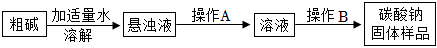
碳酸钠的溶解度随温度变化如图所示。
①溶解时用玻璃棒搅拌的目的是。
②操作B包括蒸发浓缩、(填“蒸发结晶”或“降温结晶”)、过滤、冰水洗涤2-3次、干燥,洗涤过程中使用“冰水”的目的是。
(2)“侯氏制碱法”以食盐、氨气、二氧化碳等为原料先制得NaHCO3,进而生产出纯碱。其生产过程包括以下几步反应:
a.NH3+CO2+H2O=NH4HCO3
b.NH4HCO3+NaCl=NaHCO3↓+NH4Cl
c.2NaHCO3Na2CO3+H2O+CO2↑△
反应b得到的NaHCO3中往往会含有少量的NH4HCO3,但这并不会影响最终制得的Na2CO3的纯度,原因是。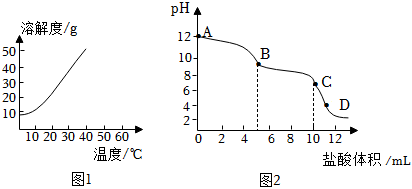
Ⅱ、碳酸钠的性质
某兴趣小组向碳酸钠溶液中逐滴加入稀盐酸,发现开始没有气泡,一段时间后才开始产生气泡。测得反应中溶液的pH变化与加入盐酸体积的关系如图2所示。
已知:本实验条件下,Na2CO3溶液和NaHCO3溶液的pH分别为12.0和8.2。
(3)由图2可知,反应主要分为AB、BC两个阶段。AB段、BC段发生的反应方程式分别为Na2CO3+HCl=NaHCO3+NaCl、。
Ⅲ、碳酸钠的应用
碳酸钠溶液和石灰乳反应是工业制烧碱的方法之一。该法制得的烧碱中混有少量Na2CO3,可用如下方法测定其中NaOH的含量,实验步骤为:称取工业烧碱2.00g,配制成50mL溶液,先加入过量BaCl2溶液3,再加入2~3滴酚酞试液,向其中逐滴加入溶质质量分数为3.65%的稀盐酸,NaOH与盐酸恰好完全反应时消耗盐酸44.00mL。(该盐酸密度近似等于1g/mL,BaCO3在该过程中不与盐酸反应)
(4)加入过量BaCl2溶液的作用是。
(5)计算该烧碱样品中NaOH的质量分数。(写出计算过程)组卷:131引用:4难度:0.3


