2022-2023学年四川省成都七中高一(下)期中化学试卷
发布:2024/8/25 0:0:8
一、选择题(包括20个小题,每小题2分,共40分,每小题只有一个选项符合题意)
-
1.下列关于无机非金属材料的说法中,不正确的是( )
组卷:47引用:2难度:0.7 -
2.SO2属于严重的大气污染物,可用H2与SO2高温反应消除SO2的污染,其反应原理可分为两步,过程如图所示。下列说法正确的是( )
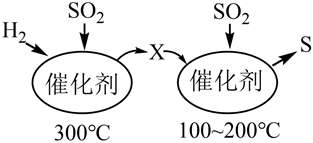 组卷:52引用:2难度:0.7
组卷:52引用:2难度:0.7 -
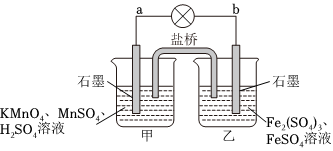 3.某合作学习小组的同学设计下列原电池,盐桥中装有饱和K2SO4溶液。下列叙述中正确的是( )组卷:103引用:3难度:0.6
3.某合作学习小组的同学设计下列原电池,盐桥中装有饱和K2SO4溶液。下列叙述中正确的是( )组卷:103引用:3难度:0.6 -
4.下列所示装置能达到实验目的的是( )
A B C D 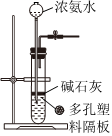
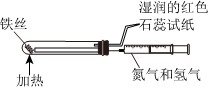
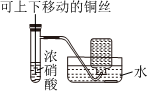
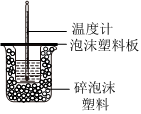
“随关随停”制取氨气 以铁丝为催化剂模拟工业合成氨并检验产物 制备并收集NO2 中和反应反应热的测定 组卷:24引用:2难度:0.7 -
5.下列离子方程式正确的是( )
组卷:37引用:2难度:0.6 -
6.设NA表示阿伏加德罗常数的值。下列说法正确的是( )
组卷:37引用:1难度:0.5 -
7.将一定物质的量的HI(g)置于2L的恒容密闭容器中,只发生反应2HI(g)⇌H2(g)+I2(g),在其他条件相同时,反应物HI(g)的物质的量n随反应时间t的变化情况如表所示:
根据表中数据,下列说法正确的是( )t/min
n/mol
实验序号(反应温度)0 10 20 30 40 50 60 1(800℃) 1.0 0.80 0.67 0.57 0.50 0.50 0.50 2(800℃) 1.2 0.92 0.75 0.63 0.60 0.60 0.60 3(820℃) 1.0 0.40 0.25 0.20 0.20 0.20 0.20 组卷:33引用:2难度:0.5 -
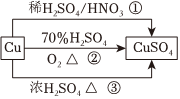 8.CuSO4是一种重要的化工原料,有关制备途径及性质如图所示。下列说法错误的是( )组卷:40引用:2难度:0.5
8.CuSO4是一种重要的化工原料,有关制备途径及性质如图所示。下列说法错误的是( )组卷:40引用:2难度:0.5
二、非选择题(包括5个小题,共60分)
-
24.研究化学反应的速率和限度对于日常生活和工农业生产都具有重要的意义。
(1)一定温度下,在2L的恒容容器中充入N2与H2各1mol,H2的物质的量随时间的变化曲线如图所示。回答下列问题: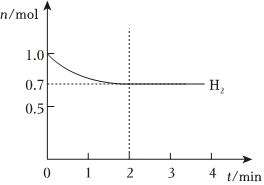
①反应0~2min,以NH3表示的平均反应速率为。
②能说明该反应达到化学平衡状态的是。
a.混合气体的密度保持不变
b.容器内的气体压强保持不变
c.3v正(H2)=2v逆(NH3)
d.N2、H2、NH3分子数之比为1:3:2
e.气体的平均相对分子质量保持不变
f.NH3的体积分数保持不变
③我国科研人员研究发现合成氨的反应历程有多种,其中有一种反应历程如图所示(吸附在催化剂表面的物质用*表示)。下列说法错误的是。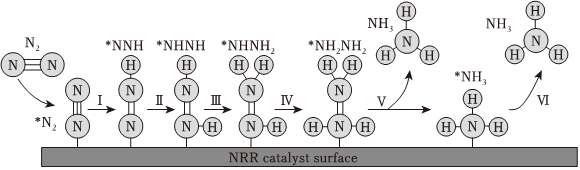
a.N2生成NH3是通过多步还原反应生成的
b.过程Ⅰ和Ⅲ中能量的变化相同
c.适当提高N2分压,可以加快N2(g)→*N2反应速率,提高N2(g)转化率
d.大量氨分子吸附在催化剂表面,将降低反应速率
(2)一种“碘钟实验”是将浓度均为0.01mol/L的H2O2、H2SO4、KI、Na2S2O3溶液及淀粉混合,一定时间后溶液变为蓝色。某小组同学在室温下对该实验原理进行探究。资料:该实验的总反应为H2O2+2S2+2H+=S4O2-3+2H2O。反应分两步进行,第i步:H2O2+2I-+2H+=I2+2H2O,第ii步:••••••O2-6
①第ii步的离子方程式是。对于总反应,I-的作用相当于。
②为探究溶液变蓝快慢的影响因素,进行实验Ⅰ、实验Ⅱ(溶液浓度均为0.01mol/L)。
实验Ⅱ中,x、y、z所对应的数值分别是实验序号 H2O2溶液 H2SO4溶液 Na2S2O3溶液 KI溶液(含淀粉) H2O 变蓝时间 实验I 5mL 4mL 8mL 3mL 0 30min 实验Ⅱ 5mL 2mL xmL ymL zmL 40min 。对比实验Ⅰ、实验Ⅱ,可得出的实验结论是。
③为探究其他因素对该“碘钟实验”的影响,进行实验Ⅲ(溶液浓度均为0.01mol/L)。
实验过程中,溶液始终无明显颜色变化。试结合该“碘钟实验”总反应方程式及第i、ii步反应速率的相对快慢关系,解释实验Ⅲ未产生颜色变化的原因实验序号 H2O2溶液 H2SO4溶液 Na2S2O3溶液 KI溶液(含淀粉) H2O 实验Ⅲ 4mL 4mL 9mL 3mL 0 。组卷:30引用:2难度:0.6 -
25.碱性锌锰电池是日常生活中常见的化学电源之一,其构造如图1,一种从废旧碱性锌锰电池回收Zn和MnO2的工艺如图2。
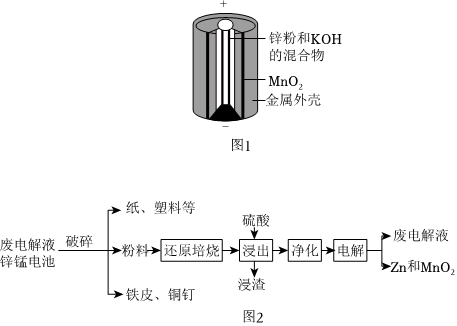
回答下列问题:
(1)MnO(OH)中Mn元素的化合价为。
(2)碱性锌锰电池工作时正极反应式为。
(3)“净化”是为了除去浸出液中的Fe2+杂质,方法是加入(填化学式)溶液将Fe2+氧化为Fe3+,再调节pH使Fe3+沉淀完全。废电解液中含有大量的H+可以返回工序中循环使用。
(4)若将“粉料”直接与浓盐酸共热反应后过滤,滤液的主要成分是ZnCl2和MnCl2,同时生成一种黄绿色气体,“粉料”中的MnO(OH)与浓盐酸共热反应的化学方程式为。
(5)“浸出”所得溶液经一系列操作后得MnSO4⋅H2O,通过煅烧MnSO4⋅H2O可制得生产软磁铁氧体材料的MnxO4,如图是煅烧MnSO4⋅H2O时温度与剩余固体质量变化曲线。该曲线中A段所表示物质的化学式为,MnxO4中x=。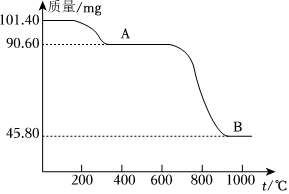 组卷:24引用:2难度:0.6
组卷:24引用:2难度:0.6


