2022-2023学年安徽省六安一中高一(上)期末化学试卷
发布:2024/9/16 1:0:9
一、单选题(每小题3分,共36分,在每小题给出的四个选项中,只有一项是符合题目要求的)
-
1.分类是科学研究的重要方法,下列物质分类正确的是( )
组卷:126引用:4难度:0.8 -
2.下列离子方程式书写正确的是( )
组卷:27引用:2难度:0.7 -
3.下列氯化物既可以由氯气与金属反应制得,又可以由金属与盐酸反应制得的是( )
组卷:132引用:7难度:0.7 -
4.“灌钢法”是我国古代劳动人民对钢铁冶炼技术的重大贡献,陶弘景在其《本草经集注》中提到“钢铁是杂炼生鍒作刀镰者”。“灌钢法”主要是将生铁和熟铁(含碳量约0.1%)混合加热,生铁熔化灌入熟铁,再锻打成钢。下列说法错误的是( )
组卷:619引用:11难度:0.9 -
5.某混合溶液中含5种离子,物质的量浓度如下表,则M的物质的量浓度以及离子符号可能为(已知HNO3具有强氧化性)( )
所含离子 NO3- SO42- Fe3+ H+ M 物质的量浓度mol/L 2 3 1 3 ? 组卷:102引用:4难度:0.5 -
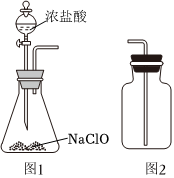 6.实验室制备Cl2可用下列反应:NaClO+2HCl(浓)═NaCl+Cl2↑+H2O。利用上述反应制备Cl2时,下列说法正确的是( )组卷:89引用:2难度:0.7
6.实验室制备Cl2可用下列反应:NaClO+2HCl(浓)═NaCl+Cl2↑+H2O。利用上述反应制备Cl2时,下列说法正确的是( )组卷:89引用:2难度:0.7
三、非选择题(共48分)
-
19.Ⅰ.氯气是一种重要的化工原料,氯气及其化合物在自来水的消毒、农药的生产、药物的合成等领域都有着重要的应用。
(1)NaClO具有较强的(填“氧化”或“还原”)性,是常用的消毒剂和漂白剂的有效成分。
(2)黄色气体ClO2可用于污水杀菌和饮用水净化。
①KClO3与SO2在强酸性溶液中反应可制得ClO2,SO2被氧化为,该反应的离子方程式为SO2-4。
②ClO2可将废水中的Mn2+氧化为MnO2而除去,本身被还原为Cl-,该反应过程中氧化剂与还原剂的物质的量之比为。
Ⅱ.某学生设计如图所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(该反应为放热反应),回答下列问题: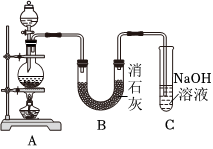
(3)实验室常用A装置制备氯气,写出该反应的离子方程式。
(4)C装置的作用是。
(5)此实验所得漂白粉的有效成分偏低,该学生经分析并查阅资料发现,主要原因是在U形管中还存在两个副反应。
①温度较高时氯气与消石灰反应生成Ca(ClO3)2,为避免此副反应的发生,可采取的措施是。
②另一个副反应会导致漂白粉中CaCl2含量偏高,为避免此副反应的发生,装置的改进措施为。组卷:78引用:2难度:0.5 -
20.实验室有一包久置的生铁粉末(成分为碳、铁和氧化铁)。为测定各组分的质量分数,小怡取两份质量均为mg的生铁粉末样品1和样品2,分别进行如图实验。
Ⅰ.测定碳的含量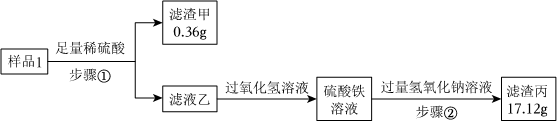
已知:过氧化氢溶液能将Fe2+转化为Fe3+。
(1)步骤①的操作名称为。
(2)溶液乙与过氧化氢溶液发生反应的离子方程式为,检验硫酸铁溶液中Fe3+存在的试剂是。
Ⅱ.测定氧化铁的质量分数
【查阅资料】①2Fe2O3+3C4Fe+3CO2↑高温
②Fe2O3+3H22Fe+3H2O↑。高温
如图所示装置气密性良好。称量丁装置质量为ag,在硬质玻璃管中放入样品2,打开止水夹K,在球形干燥管出口处检验氢气纯净后,点燃酒精灯,待充分反应后,硬质玻璃管中只有一种固体单质,熄灭酒精灯,冷却至室温,关闭止水夹K,再次称量丁装置的质量为bg。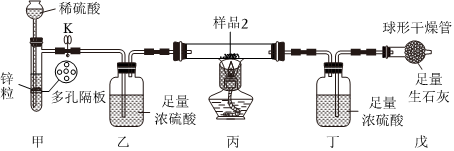
(3)若无装置乙,会导致测得氧化铁的质量分数(填“偏大”“偏小”或“不变”)。
(4)装置戊的作用为。
(5)原样品中氧化铁的质量分数为。组卷:24引用:2难度:0.7


