Ⅰ.氯气是一种重要的化工原料,氯气及其化合物在自来水的消毒、农药的生产、药物的合成等领域都有着重要的应用。
(1)NaClO具有较强的 氧化氧化(填“氧化”或“还原”)性,是常用的消毒剂和漂白剂的有效成分。
(2)黄色气体ClO2可用于污水杀菌和饮用水净化。
①KClO3与SO2在强酸性溶液中反应可制得ClO2,SO2被氧化为SO2-4,该反应的离子方程式为 2ClO-3+SO2=2ClO2+SO2-42ClO-3+SO2=2ClO2+SO2-4。
②ClO2可将废水中的Mn2+氧化为MnO2而除去,本身被还原为Cl-,该反应过程中氧化剂与还原剂的物质的量之比为 2:52:5。
Ⅱ.某学生设计如图所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(该反应为放热反应),回答下列问题:
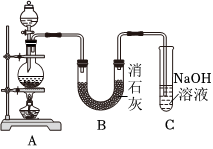
(3)实验室常用A装置制备氯气,写出该反应的离子方程式 MnO2+4H++2Cl-(浓) Δ
Mn2++Cl2↑+2H2OMnO2+4H++2Cl-(浓) Δ
Mn2++Cl2↑+2H2O。
(4)C装置的作用是 吸收未反应完的氯气,防止污染空气吸收未反应完的氯气,防止污染空气。
(5)此实验所得漂白粉的有效成分偏低,该学生经分析并查阅资料发现,主要原因是在U形管中还存在两个副反应。
①温度较高时氯气与消石灰反应生成Ca(ClO3)2,为避免此副反应的发生,可采取的措施是 冷却B装置冷却B装置。
②另一个副反应会导致漂白粉中CaCl2含量偏高,为避免此副反应的发生,装置的改进措施为 在A、B之间接一个盛有饱和NaCl溶液的洗气瓶在A、B之间接一个盛有饱和NaCl溶液的洗气瓶。
SO
2
-
4
2
C
l
O
-
3
+
S
O
2
=
2
C
l
O
2
+
S
O
2
-
4
2
C
l
O
-
3
+
S
O
2
=
2
C
l
O
2
+
S
O
2
-
4
M
n
O
2
+
4
H
+
+
2
C
l
-
(
浓
)
Δ |
M
n
2
+
+
C
l
2
↑
+
2
H
2
O
M
n
O
2
+
4
H
+
+
2
C
l
-
(
浓
)
Δ |
M
n
2
+
+
C
l
2
↑
+
2
H
2
O
【考点】氯气的化学性质.
【答案】氧化;;2:5;
;吸收未反应完的氯气,防止污染空气;冷却B装置;在A、B之间接一个盛有饱和NaCl溶液的洗气瓶
2
C
l
O
-
3
+
S
O
2
=
2
C
l
O
2
+
S
O
2
-
4
M
n
O
2
+
4
H
+
+
2
C
l
-
(
浓
)
Δ |
M
n
2
+
+
C
l
2
↑
+
2
H
2
O
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/9/16 1:0:9组卷:78引用:2难度:0.5


