2022-2023学年江苏省宿迁市沭阳县高二(上)期中化学试卷
发布:2024/8/24 2:0:8
一、单项选择题(每小题只有一个选项符合题意,每小题3分,共42分)
-
1.2022年北京冬奥会上使用的许多科技都体现了绿色环保的理念,而化学相关知识则为其提供了重要的理论支撑。下列说法错误的是( )
组卷:120引用:5难度:0.8 -
 2.炒过菜的铁锅未及时洗净(残液中含NaCl),不久便会因被腐蚀而出现红褐色锈斑.腐蚀原理如图所示,下列说法正确的是( )组卷:94引用:5难度:0.7
2.炒过菜的铁锅未及时洗净(残液中含NaCl),不久便会因被腐蚀而出现红褐色锈斑.腐蚀原理如图所示,下列说法正确的是( )组卷:94引用:5难度:0.7 -
3.下列事实中,不能用勒夏特列原理解释的是( )
组卷:68引用:4难度:0.6 -
4.在一定温度下某反应达到化学平衡,其反应过程对应能量变化如图。下列说法正确的是( )
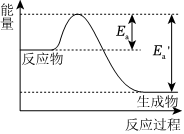 组卷:16引用:2难度:0.8
组卷:16引用:2难度:0.8 -
5.下列有关实验内容、实验装置和对应的实验目的均正确的是( )
A B C D 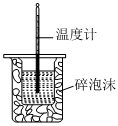
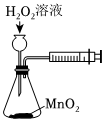
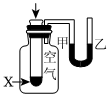
将NO2球浸泡在冷水和热水中测定中和热 测定O2的生成速率 验证反应的吸放热 比较温度对反应速率的影响 组卷:25引用:5难度:0.6 -
 6.一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是( )组卷:32引用:2难度:0.7
6.一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是( )组卷:32引用:2难度:0.7
二、解答题(共4小题,满分58分)
-
17.碘化钾溶液露置在空气中容易被氧气氧化而显黄色。某兴趣小组进行如下实验探究:
实验试剂:1mol⋅L-1KI溶液、0.1mol⋅L-1H2SO4溶液、0.2mol⋅L-1H2SO4溶液、0.1mol⋅L-1H2SO4溶液、蒸馏水
实验仪器:试管、试剂瓶、胶头滴管、温度计
(1)针对冬夏季节不同,KI溶液变色快慢不同,小组成员进行以下实验:
回答下列问题:实验编号 ① ② ③ ④ ⑤ 温度/℃ 30 40 50 60 70 显色时间/s 160 80 40 20 10
①该实验的目的是探究对反应速率的影响。
②由上述实验记录可得出的结论是:温度每升高10℃,反应速率增大为原来的倍。
(2)为探究溶液的酸性强弱对KI溶液变色速率的影响,小组成员进行以下实验:
回答下列问题:
10mL1mol⋅L-1KI溶液5滴淀粉溶液序号 加入试剂 变色时间 Ⅰ 10mL蒸馏水 长时间放置,未见明显变化 Ⅱ 10mL0.1mol⋅L-1H2SO4溶液 放置3min后,溶液变蓝 Ⅲ 10mL0.2mol⋅L-1H2SO4溶液 放置1min后,溶液变蓝 Ⅳ 10mL0.1mol⋅L-1K2SO4溶液 长时间放置,未见明显变化
①写出实验Ⅱ发生反应的离子方程式。
②实验Ⅰ、Ⅱ、Ⅲ所得结论:。
③增大实验Ⅱ反应速率还可以采取的措施。
④实验Ⅳ的作用是。组卷:12引用:2难度:0.5 -
18.化学反应伴随能量变化,获取反应能量变化有多种途径。
Ⅰ.(1)下列反应中,属于吸热反应的是(填字母)。
A.钠与水反应
B.甲烷的燃烧反应
C.Ba(OH)2⋅8H2O与氯化铵反应
D.二氧化碳与焦炭反应
Ⅱ.获取能量变化的途径
(2)通过化学键的键能计算。
已知:H2(g)+I2(g)⇌2HI(g)ΔH
下表列出了3种化学键的键能:
①ΔH=化学键 H-H I-I H-I 键能/(kJ⋅mol-1) 436 151 299 kJ⋅mol-1。
②该反应经历了如下反应历程:
第一步:I2⇌2I
第二步:H2+2I⇌2HI
若第一步为快反应,下列示意图中能体现上述反应能量变化的是(填标号)。
A. B.
B.
C. D.
D.
③下列可证明反应H2(g)+I2(g)⇌2HI(g)已达平衡状态的是(填标号)。
A.一个I-I键断裂的同时有两个H-I键断裂
B.反应速率2v(H2)=v(HI)
C.温度和体积一定时,混合气体颜色不再变化
D.条件一定时,混合气体的平均相对分子质量不再变化
(3)通过盖斯定律可计算。
甲醇既是重要的化工原料,又可作为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂作用下可合成甲醇,发生的主要反应如下
i.CO(g)+2H2(g)⇌CH3OH(g)ΔH1=-129.0kJ⋅mol-1
ii.CO2(g)+H2(g)⇌CO(g)+H2O(g)ΔH2=+41kJ⋅mol-1
iii.CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)ΔH3=。
(4)将2.0molCO2和3.0molH2通入容积为3L的恒容密闭容器中,在一定条件下发生反应ii,测得H2的平衡转化率与温度的关系如图所示。
①100℃时反应ii达到平衡所需的时间为5min,则反应从起始至5min内,用H2表示该反应的平均反应速率为。
②100℃时,反应ii的平衡常数K=。
③已知:反应ii的瞬时速率表达式为v正=k正⋅c(CO2)⋅c(H2),v逆=k逆⋅c(CO)⋅c(H2O)(k为速率常数,只与温度有关)]。温度由100℃升高到300℃,活化分子百分数(填“增大”“减小”或“不变”)。300℃时,k正k逆(填“大于”“小于”或“等于”)K(100℃)。组卷:20引用:2难度:0.5


