碘化钾溶液露置在空气中容易被氧气氧化而显黄色。某兴趣小组进行如下实验探究:
实验试剂:1mol⋅L-1KI溶液、0.1mol⋅L-1H2SO4溶液、0.2mol⋅L-1H2SO4溶液、0.1mol⋅L-1H2SO4溶液、蒸馏水
实验仪器:试管、试剂瓶、胶头滴管、温度计
(1)针对冬夏季节不同,KI溶液变色快慢不同,小组成员进行以下实验:
| 实验编号 | ① | ② | ③ | ④ | ⑤ |
| 温度/℃ | 30 | 40 | 50 | 60 | 70 |
| 显色时间/s | 160 | 80 | 40 | 20 | 10 |
①该实验的目的是探究
温度
温度
对反应速率的影响。②由上述实验记录可得出的结论是:温度每升高10℃,反应速率增大为原来的
2
2
倍。(2)为探究溶液的酸性强弱对KI溶液变色速率的影响,小组成员进行以下实验:
 10mL1mol⋅L-1KI溶液5滴淀粉溶液 |
序号 | 加入试剂 | 变色时间 |
| Ⅰ | 10mL蒸馏水 | 长时间放置,未见明显变化 | |
| Ⅱ | 10mL0.1mol⋅L-1H2SO4溶液 | 放置3min后,溶液变蓝 | |
| Ⅲ | 10mL0.2mol⋅L-1H2SO4溶液 | 放置1min后,溶液变蓝 | |
| Ⅳ | 10mL0.1mol⋅L-1K2SO4溶液 | 长时间放置,未见明显变化 |
①写出实验Ⅱ发生反应的离子方程式
4H++4I-+O2=2I2+2H2O
4H++4I-+O2=2I2+2H2O
。②实验Ⅰ、Ⅱ、Ⅲ所得结论:
溶液酸性越强,KI溶液变色越快
溶液酸性越强,KI溶液变色越快
。③增大实验Ⅱ反应速率还可以采取的措施
升高温度
升高温度
。④实验Ⅳ的作用是
为了形成对比实验,说明实际发生反应的是H+
为了形成对比实验,说明实际发生反应的是H+
。【考点】探究影响化学反应速率的因素.
【答案】温度;2;4H++4I-+O2=2I2+2H2O;溶液酸性越强,KI溶液变色越快;升高温度;为了形成对比实验,说明实际发生反应的是H+
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/8/24 2:0:8组卷:12引用:2难度:0.5
相似题
-
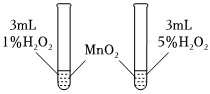 1.控制变量法是化学实验的常用方法之一,如图所示实验探究影响反应速率的因素是( )发布:2024/12/30 14:0:1组卷:44引用:3难度:0.6
1.控制变量法是化学实验的常用方法之一,如图所示实验探究影响反应速率的因素是( )发布:2024/12/30 14:0:1组卷:44引用:3难度:0.6 -
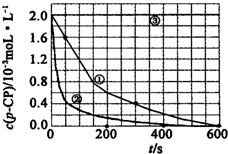 2.(一)Fenton法常用于处理含有难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响.实验中控制p-CP的初始浓度相同,恒定实验温度在298K或313K下设计如下对比实验(其余实验条件见下表):
2.(一)Fenton法常用于处理含有难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响.实验中控制p-CP的初始浓度相同,恒定实验温度在298K或313K下设计如下对比实验(其余实验条件见下表):
(1)编号③的实验目的是实验序号 实验目的 T/K pH c/10-3mol•L-1 H2O2 Fe2+ ① 为以下实验作参照物 298 3 6.0 0.30 ② 探究温度对降解反应速率的影响 313 3 6.0 0.30 ③ 298 10 6.0 0.30 .
(2)实验测得不同实验编号中p-CP的浓度随时间变化的关系如图所示.请根据实验①曲线,计算降解反应在50-300s内的平均反应速率v(p-CP)=.
(3)实验①②表明,温度与该降解反应速率的关系是.
(二)已知Fe3+和I-在水溶液中的反应为2I-+2Fe3+=2Fe2++I2.正向反应速率和I-、Fe3+的浓度关系为v=kcm(I-)cn(Fe3+)(k为常数)
(4)请分析下表提供的数据回答以下问题:
①在v=kcm(I-)cn(Fe3+)中,m、n的值为c(I-)/(mol•L-1) c(Fe3+)/(mol•L-1) v/(mol•L-1•s-1) (1) 0.20 0.80 0.032k (2) 0.60 0.40 0.144k (3) 0.80 0.20 0.128k .(选填A、B、C、D)
A.m=1,n=1 B.m=1,n=2 C.m=2,n=1 D.m=2,n=2
②I-浓度对反应速率的影响Fe3+浓度对反应速率的影响(填“<”、“>”或“=”).
(三)一定温度下,反应FeO(s)+CO(g)⇌Fe(s)+CO2(g)的化学平衡常数为3.0,该温度下将2mol FeO、4mol CO、5mol Fe、6mol CO2加入容积为2L的密闭容器中反应.请通过计算回答:
(5)v(正)v(逆)(填“>”、“<”或“=”);若将5mol FeO、4mol CO加入同样的容器中,在相同温度下达到平衡,则CO的平衡转化率为.发布:2024/12/30 14:30:1组卷:20引用:2难度:0.5 -
3.为探究影响化学反应速率的因素,某研究小组设计了如下五个实验。按要求回答下列问题(已知:Cu2+、Fe3+对H2O2的分解起催化作用)。
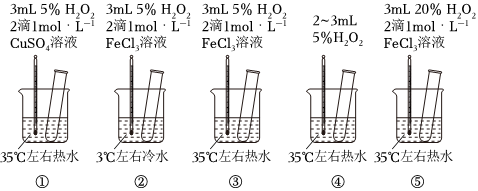
(1)为探究温度对化学反应速率的影响,应选择实验(填序号,下同),选择的依据是。
(2)为探究催化剂对化学反应速率的影响,同时探究催化剂不同催化效果不同,应选择实验。
(3)通过观察发现实验⑤比实验③现象明显,其原因是。
(4)根据上述实验,用H2O2快速制取少量O2,可采取的三条措施为。发布:2024/12/30 14:30:1组卷:8引用:5难度:0.5


