2022-2023学年上海市金山中学高二(下)期末化学试卷(合格考)
发布:2024/5/31 8:0:9
海水的综合利用
-
1.海水中含有大量的盐,故密度较大、味道咸涩。海水中所含的盐大部分是氯化钠,氯化钠是生活中和人体内不可或缺的,也被用来生产氯气以及各种含氯和含钠的制品、为人们的日常生活和化学工业提供重要的原料。从海水中不仅可以获得氯碱工业的原料——氯化钠,还可提取溴、碘、镁、钾等多种物质。其中,溴和碘在陆地上的含量较少,主要是从海洋中提取。
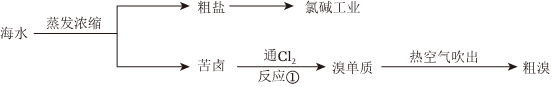
(1)粗盐提纯实验的部分操作如图所示,其中错误的是。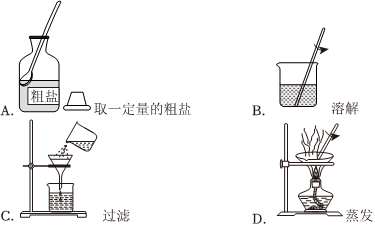
(2)粗盐中常含有可溶性的CaCl2、MgCl2、Na2SO4等杂质。可以通过如下操作除去:①加入稍过量的Na2CO3溶液;②加入稍过量的NaOH溶液;③加入稍过量的BaCl2溶液;④加入稀盐酸直至无气泡产生;⑤过滤。其中正确的操作顺序为。
A.①②③⑤④
B.②①③⑤④
C.③②①④⑤
D.③②①⑤④
(3)在氯碱工业中,常用电解饱和食盐水的方法制备氯气。中国最早的氯碱工厂是上海天原电化厂,其使用的电解饱和食盐水的装置原理简图如图所示。电解饱和食盐水的化学方程式为。电解时,铁电极上生成的气体为。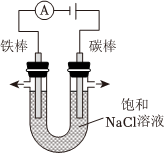
(4)如果不对粗盐进行提纯,直接电解粗盐水,可能出现的现象是。
A.阳极附近出现白色浑浊
B.阴极附近出现白色浑浊
C.粗盐水不导电,无法电解
D.产物中会混入Ca、Mg等金属杂质
(5)地球上99%的溴元素分布在海洋中。从海水中提取溴,一般要经过浓缩、氧化和提取三个步骤。其中氧化过程中发生的反应①的离子方程式为:,在反应中氯气作剂,被氧化的元素是。若在实验室中模拟海水中溴的提取,得到的单质溴可以用有机溶剂在(仪器)中实现萃取富集,萃取试剂用、苯等,得到的有机层显色。
(6)在海水提溴的过程中,常用热空气或水蒸气将溴吹出,是因为溴单质。
A.沸点低,易挥发
B.化学性质活泼
C.化学性质稳定
D.易升华
(7)在氧化过程中,通入的氯气往往是过量的。因此,得到的溴单质粗品中往往含有少量氯气。除去氯气杂质的方法是。
A.加入NaOH溶液
B.加入饱和食盐水
C.加入NaBr溶液
D.通入H2点燃组卷:22引用:1难度:0.7
氮及其化合物
-
4.氨是一种重要的化工原料,在工农业生产中有广泛的应用。
(1)下列关于氨气的叙述中,错误的是。
A.氨气遇浓盐酸冒白烟
B.氨气在一定的条件下能被氧气氧化
C.氨气能使干燥的蓝色石蕊试纸变红色
D.氨气能使酚酞试液变红色
(2)工业上合成氨气的化学方程式是:。
(3)下列表示合成氨反应的速率中,反应最快的是。
A.v(N2)=0.0003mol⋅L-1⋅s-1
B.v(H2)=0.045mol⋅L-1⋅min-1
C.v(NH3)=1.50mol⋅L-1⋅h-1
D.v(N2)=0.015mol⋅L-1⋅min-1
(4)在一个恒温恒容的密闭容器中进行合成氨反应,下列证据能判断反应已达平衡状态的是。
A.3v(N2)=v(H2)
B.气体密度不再变化
C.每消耗1molN2就同时消耗1molNH3
D.混合气体的平均摩尔质量不再变化
(5)在一个密闭容器中进行的合成氨反应,达到平衡后改变一个条件,一段时间又达到平衡,此时测得氨气的浓度增大。下列可能的原因是(双选)。
A.升高温度
B.降低温度
C.增大容器体积
D.缩小容器体积
合成氨原料之一的氢气可通过如下反应得到:CH4(g)+H2O(g)⇌CO(g)+3H2(g),1mol甲烷和1mol水蒸气的总能量小于1mol一氧化碳和3mol氢气的总能量。
(6)是一个(填“放热”或“吸热”)反应。
(7)在2L体积不变的密闭容器中进行反应CH4(g)+H2O(g)⇌CO(g)+3H2(g),测得CH4的物质的量浓度随反应时间的变化如图所示,反应进行到5min时,生成的CO的物质的量为,以H2表示的平均反应速率为。此时,若再加入1molCH4,则化学平衡将向反应方向移动,过程中正反应速率的变化为。
(8)如图所示,上述反应进行到10min时,改变外界条件导致如图所示的变化,则所改变的条件可能是。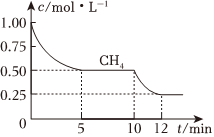
(9)工业上合成氨气的另一原料氮气是空气的主要成分,汽车发动机工作时会引发N2和O2反应,生成NOx等污染大气,其中生成NO的能量变化如图甲所示,则图中三种分子最稳定的是(写化学式)。若反应生成2molNO气体(选“吸收”或“放出”)kJ热量。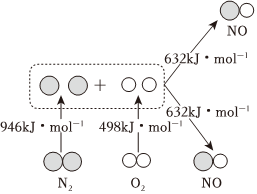 组卷:35引用:1难度:0.7
组卷:35引用:1难度:0.7
有机化学与生活
-
5.人类生活生产与有机化学密切相关,内燃机车、飞机和大部分汽车燃料来自石油化工产品,很多衣服会用到化学合成纤维作为材料。生活中常见的酒、醋、油等都是有机物。
(1)烷烃的主要来源是石油和天然气,是重要的化工原料和能源物资。下列关于烷烃的叙述不正确的是。
A.烷烃中的碳原子均以共价单键的形式与碳原子或氢原子相连
B.甲烷能够使酸性高锰酸钾溶液褪色
C.甲烷、乙烷及丙烷均无同分异构体
D.乙烷与丙烷互为同系物
(2)工业上获得大量乙烯、丙烯、丁二烯采用的方法是。
A.石油的分馏
B.煤的干馏
C.石油的裂解
D.煤的气化
(3)下列有关有机化合物说法正确的是。
A.凡有甜味的有机化合物均属于糖类
B.尼龙耐磨性高于棉花和羊毛,也是天然高分子材料
C.蛋白质、油脂、糖类是三大基本营养物质
D.工业制备肥皂利用了油脂在酸性条件下的水解反应
(4)所有原子不可能处于同一平面的是。
A.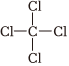
B.CH2=CH2
C.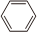
D.CH=CH—C≡CH
(5)设NA为阿伏加德罗常数的值,下列说法正确的是。
A.2mol C4H8含有的碳碳双键数目为2NA
B.标准状况下,1mol苯乙烯中含有的碳碳双键数目为NA
C.1mol乙醇与足量乙酸充分反应,生成的乙酸乙酯数目为NA
D.标准状况下,22.4L溴乙烷中含有的溴原子数目为NA
在光照条件下,乙烷和氯气可以发生一系列反应。某课外活动小组利用如图所示装置探究甲烷和氯气的反应: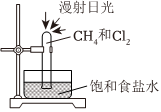
(6)实验中可观察到的现象有(双选)。
A.试管内液面上升,最终充满试管
B.试管内气体颜色逐渐变深
C.试管内壁出现油状液滴
D.试管内有少量白雾生成
(7)用饱和食盐水而不用水的原因是。
(8)请写出生成一氯甲烷的化学反应方程式:。
(9)已知B是酒的主要成分、C是食醋的主要成分。如图是相关有机物的转换关系: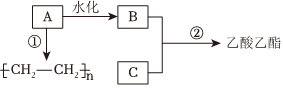
A的结构简式为,工业上生产A所需的矿物资源是。
(10)请写出C的官能团名称。
(11)反应②的化学方程式为。
(12)实验室用如图装置制取乙酸乙酯。实验时需预先在用于收集乙酸乙酯的试管b中加入饱和碳酸钠溶液。实验结束后,发现试管b中的液体分两层,乙酸乙酯在层(填“上”或“下”),分离乙酸乙酯的实验操作方法是。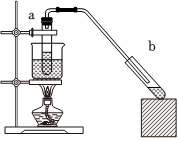 组卷:32引用:1难度:0.5
组卷:32引用:1难度:0.5


