氨是一种重要的化工原料,在工农业生产中有广泛的应用。
(1)下列关于氨气的叙述中,错误的是 CC。
A.氨气遇浓盐酸冒白烟
B.氨气在一定的条件下能被氧气氧化
C.氨气能使干燥的蓝色石蕊试纸变红色
D.氨气能使酚酞试液变红色
(2)工业上合成氨气的化学方程式是:N2+3H2催化剂高温高压2NH3N2+3H2催化剂高温高压2NH3。
(3)下列表示合成氨反应的速率中,反应最快的是 AA。
A.v(N2)=0.0003mol⋅L-1⋅s-1
B.v(H2)=0.045mol⋅L-1⋅min-1
C.v(NH3)=1.50mol⋅L-1⋅h-1
D.v(N2)=0.015mol⋅L-1⋅min-1
(4)在一个恒温恒容的密闭容器中进行合成氨反应,下列证据能判断反应已达平衡状态的是 DD。
A.3v(N2)=v(H2)
B.气体密度不再变化
C.每消耗1molN2就同时消耗1molNH3
D.混合气体的平均摩尔质量不再变化
(5)在一个密闭容器中进行的合成氨反应,达到平衡后改变一个条件,一段时间又达到平衡,此时测得氨气的浓度增大。下列可能的原因是 BDBD(双选)。
A.升高温度
B.降低温度
C.增大容器体积
D.缩小容器体积
合成氨原料之一的氢气可通过如下反应得到:CH4(g)+H2O(g)⇌CO(g)+3H2(g),1mol甲烷和1mol水蒸气的总能量小于1mol一氧化碳和3mol氢气的总能量。
(6)是一个 吸热吸热(填“放热”或“吸热”)反应。
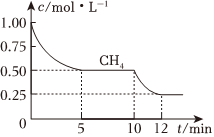
(7)在2L体积不变的密闭容器中进行反应CH4(g)+H2O(g)⇌CO(g)+3H2(g),测得CH4的物质的量浓度随反应时间的变化如图所示,反应进行到5min时,生成的CO的物质的量为 1.0mol1.0mol,以H2表示的平均反应速率为 0.3mol⋅L-1⋅min-10.3mol⋅L-1⋅min-1。此时,若再加入1molCH4,则化学平衡将向 正正反应方向移动,过程中正反应速率的变化为 先增大,然后慢慢减小至不变先增大,然后慢慢减小至不变。
(8)如图所示,上述反应进行到10min时,改变外界条件导致如图所示的变化,则所改变的条件可能是 升高温度或者及时分离出H2O蒸气升高温度或者及时分离出H2O蒸气。
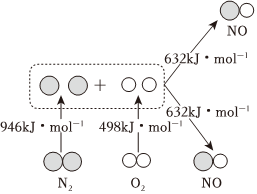
(9)工业上合成氨气的另一原料氮气是空气的主要成分,汽车发动机工作时会引发N2和O2反应,生成NOx等污染大气,其中生成NO的能量变化如图甲所示,则图中三种分子最稳定的是 N2N2(写化学式)。若反应生成2molNO气体 吸收吸收(选“吸收”或“放出”) 180180kJ热量。
催化剂
高温高压
催化剂
高温高压
【答案】C;N2+3H22NH3;A;D;BD;吸热;1.0mol;0.3mol⋅L-1⋅min-1;正;先增大,然后慢慢减小至不变;升高温度或者及时分离出H2O蒸气;N2;吸收;180
催化剂
高温高压
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/5/22 8:0:8组卷:35引用:1难度:0.7


