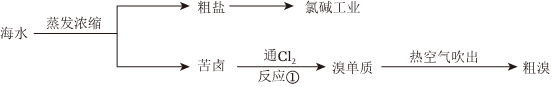
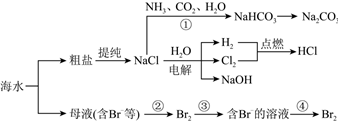
海水中含有大量的盐,故密度较大、味道咸涩。海水中所含的盐大部分是氯化钠,氯化钠是生活中和人体内不可或缺的,也被用来生产氯气以及各种含氯和含钠的制品、为人们的日常生活和化学工业提供重要的原料。从海水中不仅可以获得氯碱工业的原料——氯化钠,还可提取溴、碘、镁、钾等多种物质。其中,溴和碘在陆地上的含量较少,主要是从海洋中提取。
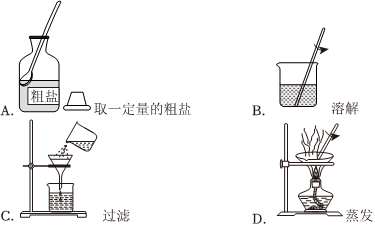
(1)粗盐提纯实验的部分操作如图所示,其中错误的是 CC。
(2)粗盐中常含有可溶性的CaCl2、MgCl2、Na2SO4等杂质。可以通过如下操作除去:①加入稍过量的Na2CO3溶液;②加入稍过量的NaOH溶液;③加入稍过量的BaCl2溶液;④加入稀盐酸直至无气泡产生;⑤过滤。其中正确的操作顺序为 DD。
A.①②③⑤④
B.②①③⑤④
C.③②①④⑤
D.③②①⑤④
(3)在氯碱工业中,常用电解饱和食盐水的方法制备氯气。中国最早的氯碱工厂是上海天原电化厂,其使用的电解饱和食盐水的装置原理简图如图所示。电解饱和食盐水的化学方程式为 2NaCl+2H2O 通电 2NaOH+Cl2↑+H2↑2NaCl+2H2O 通电 2NaOH+Cl2↑+H2↑。电解时,铁电极上生成的气体为 H2H2。
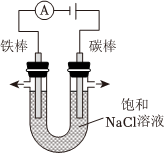
(4)如果不对粗盐进行提纯,直接电解粗盐水,可能出现的现象是 BB。
A.阳极附近出现白色浑浊
B.阴极附近出现白色浑浊
C.粗盐水不导电,无法电解
D.产物中会混入Ca、Mg等金属杂质
(5)地球上99%的溴元素分布在海洋中。从海水中提取溴,一般要经过浓缩、氧化和提取三个步骤。其中氧化过程中发生的反应①的离子方程式为:Cl2+2Br-=Br2+2Cl-Cl2+2Br-=Br2+2Cl-,在反应中氯气作 氧化氧化剂,被氧化的元素是 -1价的溴-1价的溴。若在实验室中模拟海水中溴的提取,得到的单质溴可以用有机溶剂在 分液漏斗分液漏斗(仪器)中实现萃取富集,萃取试剂用 CCl4CCl4、苯等,得到的有机层显 红棕色红棕色色。
(6)在海水提溴的过程中,常用热空气或水蒸气将溴吹出,是因为溴单质 AA。
A.沸点低,易挥发
B.化学性质活泼
C.化学性质稳定
D.易升华
(7)在氧化过程中,通入的氯气往往是过量的。因此,得到的溴单质粗品中往往含有少量氯气。除去氯气杂质的方法是 CC。
A.加入NaOH溶液
B.加入饱和食盐水
C.加入NaBr溶液
D.通入H2点燃
通电
通电
【答案】C;D;2NaCl+2H2O 2NaOH+Cl2↑+H2↑;H2;B;Cl2+2Br-=Br2+2Cl-;氧化;-1价的溴;分液漏斗;CCl4;红棕色;A;C
通电
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/5/31 8:0:9组卷:22引用:1难度:0.7
相似题
-
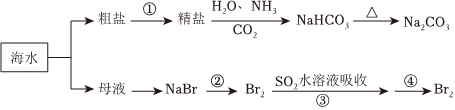
1.海洋中有丰富的食品、矿产、能源、药物和水产资源,下图为海水利用的部分过程。下列有关说法不正确的是( )
 发布:2024/12/30 3:30:1组卷:130引用:9难度:0.6
发布:2024/12/30 3:30:1组卷:130引用:9难度:0.6 -
2.海水是化学元素的宝库,从海水中可以提取或生产多种化工原料,如食盐、氯气、单质溴、镁、纯碱等,它们在工农业生产中有着广泛的用途.根据学过的知识回答下列问题:
(1)某化学兴趣小组计划用氯气和氢氧化钠制取简易消毒液.
①其反应原理为:(用离子方程式表示).
②配制250mL 4.0mol•L-1NaOH溶液,需要用到的玻璃仪器,除烧杯、玻璃棒外,还必须用到的是.
(2)工业制得粗硅后,再与氯气等物质发生反应,最终得到纯硅.请写出工业制取粗硅的化学方程式:
(3)金属镁被誉为“国防金属”,若镁起火,不能用CO2来灭火,其原因可用化学方程式表示为
(4)①若Na2CO3固体中混有少量NaHCO3杂质,除去杂质的方法是,
②若NaHCO3溶液中混有少量Na2CO3杂质,除去杂质的方法是.发布:2024/10/27 17:0:2组卷:11引用:1难度:0.5 -
3.海水资源开发利用的部分过程如图所示:
下列说法正确的是( )发布:2024/11/3 6:0:1组卷:51引用:3难度:0.7


