人教版(2019)选择性必修1《3.2.1 水的电离 溶液的酸碱性与pH》2023年同步练习卷(6)
发布:2024/8/16 15:0:1
一、选择题
-
1.下列叙述正确的是( )
组卷:33引用:4难度:0.6 -
2.25℃时,纯水的Kw=1×10-14,100℃时,纯水的Kw=5.45×10-13,这说明( )
组卷:52引用:5难度:0.8 -
3.25℃时,下列溶液中,碱性最强的是( )
组卷:21引用:4难度:0.7 -
4.用pH试纸测定溶液pH的正确操作是( )
组卷:13引用:3难度:0.7
四、解答题
-
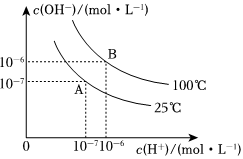 12.在水的电离平衡中,c(H+)和c(OH-)的关系如图所示:
12.在水的电离平衡中,c(H+)和c(OH-)的关系如图所示:
(1)A点水的离子积为1×10-4,B点水的离子积为.
造成水的离子积变化的原因是.
(2)100℃时,0.01mol/LNaOH溶液的pH=.
(3)100℃时,将pH=11的NaOH溶液与pH=2的稀盐酸混合,欲使混合溶液呈中性,则NaOH溶液与盐酸体积比为.组卷:55引用:4难度:0.3 -
13.任何物质的水溶液都存在水的电离平衡。如表是不同温度下水的离子积数据:
完成下列填空:温度(℃) 25 t1 t2 水的离子积常数 1×10-14 a 1×10-12
(1)25℃时,向100mL纯水中加入0.01mol的NH4Cl固体,(选填“促进”或“抑制”)了水的电离平衡,所得溶液呈性(选填“酸”、“碱”或“中”),原因是(用离子反应方程式表示)。
(2)若25<t1<t2,则a1×10-14(选填“>”、“<”或“=”),理由是。
(3)t1℃时,测得纯水的c(H+)=2.4×10-7mol/L,则c(OH-)=mol/L;该温度下某盐酸溶液的c(Cl-)=0.01mol/L,该溶液的c(OH-)=mol/L。
(4)t2℃时,0.01mol/L的NaOH溶液的pH=。组卷:41引用:2难度:0.7


