2022-2023学年四川省凉山州安宁河联盟高二(下)期末化学试卷
发布:2024/6/8 8:0:9
一、选择题:本题共20小题,每小题2分,共40分。在每小题给出的四个选项中,只有一项是符合题目要求的。
-
1.化学与生产、生活密切相关,对提高人类生活质量和促进社会发展具有重要作用。下列说法正确的是( )
组卷:4引用:1难度:0.7 -
2.下列物质属于强电解质的是( )
组卷:65引用:1难度:0.8 -
3.下列化学用语或图示表述表示不正确的是( )
组卷:13引用:1难度:0.7 -
4.NA为阿伏加德罗常数的值,下列说法正确的是( )
组卷:46引用:1难度:0.6 -
5.可逆反应A(g)+B(g)⇌2C(g)+D(g)进行过程中的能量变化如图所示,下列叙述正确的是( )
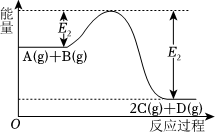 组卷:73引用:1难度:0.7
组卷:73引用:1难度:0.7 -
6.NaOH标准溶液的配制和标定,需经过NaOH溶液配制、基准物质H2C2O4•2H2O的称量以及用NaOH溶液滴定等操作。下列有关说法正确的是( )
组卷:74引用:19难度:0.9 -
7.下列实验操作、现象及所得结论均正确的是( )
实验操作 实验操作 现象 结论 A 将水加入到下列装置中 
U形管内的红墨水液面左低右高 Na2O2与水的反应为放热反应 B 将足量的SO2通入酸性高锰酸钾溶液 溶液的紫色褪去 SO2具有漂白性 C 将红热的铂丝伸入如图所示的锥形瓶中 
瓶口出现少量红棕色气体 氨的氧化产物为NO2 D 向乙醇中加入一小粒金属钠 产生无色气体 乙醇中含有水 组卷:6引用:1难度:0.5 -
8.下列说法不正确的是( )
组卷:30引用:1难度:0.8
二、非选择题:本题共6小题,共60分。
-
25.有效去除大气中的H2S、SO2以及废水中的硫化物是环境保护的重要课题。
(1)H2S与CO2在高温下发生反应:H2S(g)+CO2(g)⇌COS(g)+H2O(g)。在610K时,将0.40molH2S与0.20molCO2充入5L的钢瓶中,反应达到平衡后水的物质的量分数为0.2。
①上述条件下H2S的平衡转化率α1=。
②若在620K重复实验,平衡后水的物质的量分数为0.3,该反应的ΔH0(填“<”“>”或“=”)。
③在610K时反应H2S(g)+CO2(g)⇌COS(g)+H2O(g)平衡建立的基础上,改变下列一种条件,能使H2S平衡转化率增大的是(填标号)。
A.向容器中通入H2S
B.向容器中通入CO2
C.加入催化剂
D.缩小容器的体积
(2)在气体总压强分别为p1和p2时,反应2SO3(g)⇌2SO2(g)+O2(g)在不同温度下达到平衡,测得SO3(g)及SO2(g)的物质的量分数如图所示:
①压强:p2p1(填“>”或“<”),判断的理由是。
②若p1=8.1MPa,起始时充入amol的SO3(g)发生反应,计算Q点对应温度下该反应的平衡常数Kp=MPa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。组卷:41引用:1难度:0.6 -
26.FeCl3是饮用水、工业用水、城市污水及游泳池循环水处理的高效廉价絮凝剂,也是中学实验室中常见的试剂。某实验小组用以下装置制备FeCl3固体,并探究FeCl3溶液与Cu的反应。
已知:FeCl3晶体易升华,FeCl3易水解。
Ⅰ.FeCl3的制备
(1)装置C中碱石灰的作用是。
(2)从D、E、F中选择合适的装置制备纯净的Cl2,正确的接口顺序为a→(可选试剂:饱和食盐水、NaOH溶液、浓硫酸、碱石灰,仪器可以重复使用)。
(3)写出装置D中制备Cl2的离子方程式:。
Ⅱ.探究FeCl3溶液与Cu的反应
向4mL0.1mol/LFeCl3溶液中滴加几滴0.2mol/LKSCN溶液,溶液变红;再加入过量Cu粉,溶液红色褪去,不久有白色沉淀产生。
查阅资料可知:CuCl和CuSCN均为难溶于水的白色固体。针对白色沉淀同学们有以下猜想:
猜想1:Cu2+与过量的Cu粉反应生成Cu+,再结合Cl-生成白色沉淀CuCl。
猜想2:Cu2+与SCN-发生氧化还原反应生成Cu+,再结合SCN-生成白色沉淀CuSCN。
针对上述猜想,实验小组同学设计了以下实验:
(4)实验结果说明猜想实验编号 操作 现象 实验1 
加入铜粉后无现象 实验2 
溶液很快由蓝色变为绿色,未观察到白色沉淀;2h后溶液为绿色,未观察到白色沉淀;24h后,溶液绿色变浅,试管底部有白色沉淀 (填“1”或“2”)不合理。
(5)根据实验现象进一步查阅资料发现:
i.Cu2+与SCN可发生如下两种反应:
反应A:Cu2++4SCN-=[Cu(SCN)4]2-(淡黄色)
反应B:2Cu2++4SCN-=2CuSCN↓+(SCN)2(黄色)。
ii.[Cu(SCN)4]2-与Cu2+共存时溶液显绿色。
①由实验2中的现象推测,反应速率:A(填“>”或“<”)B,说明反应B(填“是”或“不是”)产生CuSCN的主要原因。
②进一步查阅资料可知,当反应体系中同时存在Fe2+、Cu2+、SCN时,Cu2+氧化性增强,可将Fe2+氧化为Fe3+。据此将实验2改进,向CuSO4溶液中同时加入KSCN、FeCl2,立即生成白色沉淀CuSCN,写出该反应离子方程式:。组卷:21引用:1难度:0.6


