2022-2023学年贵州省贵阳市清华中学高二(上)月考化学试卷(11月份)
发布:2024/9/22 3:0:20
一、选择题(14小题,每小题3分,共42分.每小题只有一个选项最符合题意)
-
1.核酸检测管中浸泡咽拭子的红色溶液是加入了酚红钠盐指示剂(变色pH如图)的病毒保存液。如果该试样因非必要细菌增殖而变质(已知细菌繁殖会产生CO2;饱和碳酸浓度为0.03mol•L-1;lg6=0.78),核酸检测管中溶液变质后最不可能表现出什么颜色( )
 组卷:7引用:1难度:0.5
组卷:7引用:1难度:0.5 -
2.为除去MgCl2酸性溶液中的Fe3+,可在加热搅拌的条件下加入的一种试剂是( )
组卷:33引用:5难度:0.9 -
3.已知:Ag2SO4微溶于水,Ag2SO3难溶于水。对Ag2SO3饱和溶液改变下列条件,可使
减小,同时c(Ag+)增大的是( )c(SO2-3)组卷:1引用:1难度:0.7 -
4.室温下,往0.001mol⋅L-1的氨水中滴入几滴酚酞试液时,溶液呈现粉红色。现采取下列措施,其中能使滴有酚酞的氨水溶液颜色变浅的是( )
组卷:253引用:3难度:0.6 -
5.下列方程式书写正确的是( )
组卷:5引用:1难度:0.5 -
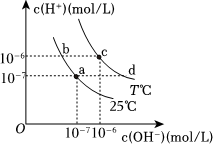 6.在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系。下列说法正确的是( )组卷:4引用:1难度:0.6
6.在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系。下列说法正确的是( )组卷:4引用:1难度:0.6
第Ⅱ卷;非选择题(共58分)
-
18.电离平衡常数是衡量弱电解质电离程度大小的量,已知部分物质的电离常数如表所示,请回答下列有关问题.
(1)向一定浓度的Na2CO3溶液滴入酚酞的现象为化学式 电离平衡常数(25℃) HClO Ka=3.0×10-8 CH3COOH Ka=1.8×10-5 H2CO3 Ka1=4.3×10-7、Ka2=5.6×10-11 H2C2O4 Ka1=5.6×10-2、Ka2=1.5×10-4 NH3⋅H2O Kb=1.8×10-5 ,请用离子方程式解释原因:.
(2)25℃时,等浓度的①NaClO溶液,②Na2CO3溶液,③CH3COONa溶液,三种溶液的pH值由大到小的顺序为(用序号表示).
(3)下列微粒可以大量共存的是.
A.、CH3COOHCO2-3
B.、HClOHCO-3
C.H2CO3、ClO-
D.H2C2O4、HCO-3
(4)体积均为10mL、pH=2的醋酸溶液与某一元酸a分别加水稀释至1000mL,稀释过程pH变化如图: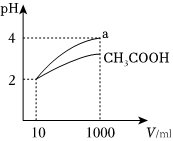
在体积、pH均相同的CH3COOH与某一元酸a中加入足量的锌,生成的氢气在标准状况下的体积大小关系:CH3COOH某酸a(填“>”、“<”或“=”).
(5)高氯酸、硫酸的酸性不同,但在水溶液中难于区分他们的酸性强弱,因为二者在水溶液中均完全电离,但是在冰醋酸中能够区分,已知硫酸在冰醋酸中部分电离,请写出硫酸在冰醋酸中的电离方程式:.组卷:7引用:1难度:0.6 -
19.高品质MnO2可用于生产锂离子电池正极材料锰酸锂.以软锰矿与黄铁矿为主要原料采用“两矿一步浸出法”制备高品质MnO2的某工艺流程如图所示:
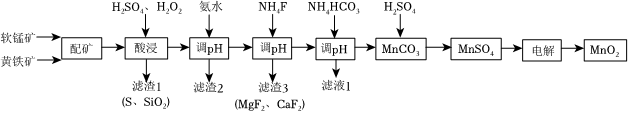
已知:①软锰矿与黄铁矿的主要成分为MnO2、FeS2,还含少量FeO、Fe2O3、MgO、Al2O3、SiO2等杂质;
②该工艺条件下,相关金属离子完全形成氢氧化物沉淀的pH如下:
回答下列问题:金属离子 Fe2+ Fe3+ Mn2+ Mg2+ Al3+ 开始沉淀pH 6.9 1.9 6.6 9.1 3.4 沉淀完全(c=1.0×10-5mol⋅L-1)的pH 8.3 3.2 10.1 10.9 4.7
(1)“配矿”过程中,将软锰矿与黄铁矿粉碎混匀的目的是.
(2)“酸浸”操作中需先后分批加入H2SO4、H2O2.加入H2SO4后发生酸浸过程的主要反应离子方程式为2FeS2+3MnO2+12H+═2Fe3++3Mn2++4S↓+6H2O,2Fe2++MnO2+4H+═2Fe3++Mn2++2H2O.
①已知滤渣1的主要成分为S、SiO2等,其附着在矿粉颗粒表面使上述反应受阻,此时加入H2O2,利用其迅速分解产生的大量气泡可破除该不利影响.分析导致H2O2迅速分解的因素是.
②矿粉颗粒表面附着物被破除后,H2O2可继续与MnO2在酸性条件下反应,产生更多Mn2+,并伴有气体生成,该反应的离子方程式是.
③H2O2除上述作用外,还可以将溶液中未与MnO2反应的Fe2+转化为Fe3+,其目的是:.
(3)“调pH”时调节溶液pH范围为4.7~6.0,此时“滤渣2”的主要成分为(填化学式).
(4)“用NH4F除杂”时,溶液体系中的Ca2+和Mg2+形成氟化物沉淀.若沉淀后上层清液中c(F-)=c(F2)=0.05mol/L,则=c(Ca2+)c(Mg2+)[已知Ksp(MgF2)=5.0×10-11,Ksp(CaF2)=2.5×10-9].组卷:11引用:1难度:0.4


