电离平衡常数是衡量弱电解质电离程度大小的量,已知部分物质的电离常数如表所示,请回答下列有关问题.
| 化学式 | 电离平衡常数(25℃) |
| HClO | Ka=3.0×10-8 |
| CH3COOH | Ka=1.8×10-5 |
| H2CO3 | Ka1=4.3×10-7、Ka2=5.6×10-11 |
| H2C2O4 | Ka1=5.6×10-2、Ka2=1.5×10-4 |
| NH3⋅H2O | Kb=1.8×10-5 |
溶液呈红色
溶液呈红色
,请用离子方程式解释原因:CO
2
-
3
HCO
-
3
CO
2
-
3
HCO
-
3
(2)25℃时,等浓度的①NaClO溶液,②Na2CO3溶液,③CH3COONa溶液,三种溶液的pH值由大到小的顺序为
③>①>②
③>①>②
(用序号表示).(3)下列微粒可以大量共存的是
B
B
.A.
CO
2
-
3
B.
HCO
-
3
C.H2CO3、ClO-
D.H2C2O4、
HCO
-
3
(4)体积均为10mL、pH=2的醋酸溶液与某一元酸a分别加水稀释至1000mL,稀释过程pH变化如图:
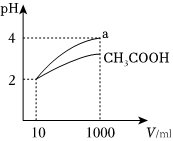
在体积、pH均相同的CH3COOH与某一元酸a中加入足量的锌,生成的氢气在标准状况下的体积大小关系:CH3COOH
>
>
某酸a(填“>”、“<”或“=”).(5)高氯酸、硫酸的酸性不同,但在水溶液中难于区分他们的酸性强弱,因为二者在水溶液中均完全电离,但是在冰醋酸中能够区分,已知硫酸在冰醋酸中部分电离,请写出硫酸在冰醋酸中的电离方程式:
H2SO4⇌H++
HSO
-
4
H2SO4⇌H++
.HSO
-
4
【考点】弱电解质的电离平衡.
【答案】溶液呈红色;+H2O⇌+OH-;③>①>②;B;>;H2SO4⇌H++
CO
2
-
3
HCO
-
3
HSO
-
4
【解答】
【点评】
声明:本试题解析著作权属菁优网所有,未经书面同意,不得复制发布。
发布:2024/9/22 3:0:20组卷:7引用:1难度:0.6


