人教版(2019)选择性必修1《第2章 化学反应速率与化学平衡》2023年单元测试卷(1)(1)
发布:2024/8/16 8:0:1
一、选择题
-
1.下列有关说法正确的是( )
组卷:43引用:11难度:0.7 -
2.将等物质的量的A、B混合于2L的密闭容器中,发生下列反应:3A(g)+B(g)⇌xC(g)+2D(g),经2min后测得D的浓度为0.5mol/L,c(A):c(B)=3:5,以C表示的平均速率v(C)=0.25mol•L-1•min-1,下列说法正确的是( )
组卷:129引用:24难度:0.7 -
3.一定温度下,向一密闭容器中充入一定量的N2和O2,在电火花作用下发生反应N2+O2═2NO,前4s用N2表示的反应速率为0.1mol/(L•s),则8s末NO的浓度为( )
组卷:204引用:4难度:0.6 -
4.已知反应CO(g)+H2O(g)⇌CO2(g)+H2(g)△H<0。在一定温度和压强下于密闭容器中,反应达到平衡。下列叙述正确的是( )
组卷:22引用:7难度:0.5 -
5.下列由实验得出的结论正确的是( )
选项 实验 结论 A 常温下,测得0.1mol/LNaA溶液的pH小于0.1mol/LNaB溶液的pH 酸性:HA<HB B 向pH=3的醋酸溶液中,加入醋酸钠溶液,溶液pH增大 醋酸钠溶液呈碱性 C 向2支盛有5mL不同浓度的Na2S2O3溶液的试管中同时加入5mL 0.1mol/L硫酸溶液,记录出现浑浊的时间 探究浓度对反应速率的影响 D 向盛有2mL 0.1mol/LAgNO3的试管中滴加5滴0.1mol/LNaCl溶液,出现白色沉淀;再往试管中滴加5滴0.1mol/LKI溶液,出现黄色沉淀 Ksp(AgCl)>Ksp(AgI) 组卷:10引用:2难度:0.5 -
6.对于可逆反应:2A(g)+B(g)⇌2C(g);△H<0,(ω(C)代表C的质量分数)下列图象正确的是
( )组卷:28引用:3难度:0.7
三、解答题
-
 19.汽车尾气中排放的NOx和CO污染环境,在汽车尾气系统中装置催化转化器,可有效降低NOx和CO的排放。
19.汽车尾气中排放的NOx和CO污染环境,在汽车尾气系统中装置催化转化器,可有效降低NOx和CO的排放。
已知:①2CO(g)+O2(g)⇌2CO2(g)△H1=-566.0kJ/mol,
②N2(g)+O2(g)⇌2NO(g)△H2=+180.5kJ/mol,
③2NO(g)+O2(g)⇌2NO2(g)△H3=-116.5kJ/mol。
回答下列问题:
(1)CO的燃烧热为。
(2)热化学方程式2NO2(g)+4CO(g)⇌N2(g)+4CO2(g)△H4=
(3)为了模拟反应2NO(g)+2CO(g)⇌N2(g)+2CO2(g)在催化转化器内的工作情况,控制一定条件,让反应在恒容密闭容器中进行,用传感器测得不同时间NO和CO的浓度如下表:
①前2s内的平均反应速率v(N2)=时间/s 0 1 2 3 4 5 c(NO)/(10-4 mol•L-1) 10.0 4.50 2.50 1.50 1.00 1.00 c(CO)/(10-3mol•L-1) 3.60 3.05 2.85 2.75 2.70 2.70 ,此温度下,该反应的平衡常数K=。
②能说明上述反应达到平衡状态的是。
A.2n(CO2)=n(N2)
B.混合气体的平均相对分子质量不变
C.气体密度不变
D.容器内气体压强不变
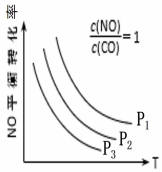
③当NO与CO浓度相等时,体系中NO的平衡转化率与温度、压强的关系如图所示,则NO的平衡转化率随温度升高而减小的原因是。图中压强(p1、p2、p3)的大小顺序为。组卷:21引用:2难度:0.5 -
20.天然气的主要成分为CH4,一般还含有C2H6等烃类,是重要的燃料和化工原料。回答下列问题:
(1)乙烷在一定条件可发生如下反应:C2H6(g)⇌C2H4(g)+H2(g),2L密闭容器中通入等物质的量的乙烷和氢气,在等压下(p)发生上述反应,乙烷的平衡转化率为α。反应的平衡常数Kx=(用物质的量分数代替平衡浓度计算)。
(2)已知反应CaCO3(s)=CaO(s)+CO2(g)△H(298K)=+178.2kJ•mol-1,△S(298K)=+169.6J•mol-1•K-1,则该反应能自发进行的最低温度为K(假设反应的焓变与熵变不随温度变化而变化,结果保留整数)。
(3)恒温条件下,在体积可变的密闭容器中发生反应CO(g)+2H2(g)⇌CH3OH(g),达到平衡时,测得CO、H2、CH3OH分别为1mol、1mol、1mol,容器的体积为3L。再往容器中通入3mol CO,此时平衡将移动(填“向右”、“向左”或“不”)。
(4)工业合成氨中制取氢气的原理如下:
Ⅰ:CH4(g)+H2O(g)⇌CO(g)+3H2(g)△H=+206.4kJ•mol-1
Ⅱ:CO(g)+H2O(g)⇌CO2(g)+H2(g)△H=-41.2kJ•mol-1
①对于反应Ⅰ,一定可以提高平衡体系中H2百分含量,又能加快反应速率的是(填字母)。
a.升高温度
b.增大水蒸气浓度
c.加入催化剂
d.降低压强
②下列措施可以提高CH4转化率的是(填字母)。
a.适当升高温度
b.将H2从反应体系中分离出来
c.保持体积不变充入He,使体系总压强增大
d.按原比例再充入CH4(g)和H2O(g)
(5)乙烯(C2H4)是重要的化工原料,乙炔(C2H2)选择性加氢合成乙烯是科学家当前关注的热点。70℃时,反应C2H2(g)+H2(g)⇌C2H4(g)△H=-174kJ•mol-1在刚性容器中达到平衡。
①测得在某催化剂上生成乙烯速率方程为v=0.585[p(C2H2)]-0.36•[p(H2)]0.85,p(H2)一定时,若p1(C2H2)>p2(C2H2),则v1v2(填“>”“<”或“=”)。
②在催化剂作用下,110℃时按体积比=1:4充入刚性容器中,发生反应C2H2+H2=C2H4、C2H2+2H2=C2H6。若乙炔完全反应时,乙烯的体积分数为20%,则H2的转化率为V(C2H2)V(H2),C2H4的选择性为,(C2H4的选择性=×100%)C2H4的物质的量反应的C2H2的物质的量组卷:26引用:2难度:0.6


