2022-2023学年山东省济南市历城二中高三(上)一轮复习化学试卷
发布:2024/9/6 1:0:8
一、单选题(每小题只有一个选项符合题目要求,20分)
-
1.已知反应:2FeCr2O4+7Na2O2
4Na2CrO4+X+3Na2O,下列说法错误的是( )高温组卷:51引用:3难度:0.6 -
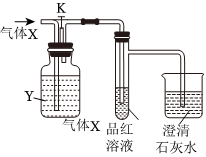 2.如图是一套检验气体性质的实验装置图。向装置中缓慢通入气体X,若关闭活塞K,则品红溶液无变化,而澄清石灰水变浑浊;若打开活塞K,则品红溶液褪色。据此判断气体X和洗气瓶内溶液Y可能是( )
2.如图是一套检验气体性质的实验装置图。向装置中缓慢通入气体X,若关闭活塞K,则品红溶液无变化,而澄清石灰水变浑浊;若打开活塞K,则品红溶液褪色。据此判断气体X和洗气瓶内溶液Y可能是( )A B C D X SO2 SO2 CO2 Cl2 Y 饱和NaHCO3溶液 浓硫酸 Na2SO3溶液 Na2SO3溶液 组卷:8引用:1难度:0.6 -
3.NA为阿伏加德罗常数的值。下列说法错误的是( )
组卷:276引用:11难度:0.6 -
4.下列实验操作、现象及得出的结论均正确的是( )
选项 实验操作 实验现象 实验结论 A 向某溶液中先加入氯化钡溶液,再滴入盐酸 先产生白色沉淀,后白色沉淀不消失 该溶液中一定含有 SO2-4B 向某溶液中加入氢氧化钠溶液,将湿润的红色石蕊试纸置于试管口 试纸不变蓝 该溶液中一定无 NH+4C 在0.1mol•L-1K2S溶液中滴加少量等浓度的ZnSO4溶液,再加入少量等浓度的CuSO4溶液 先产生白色沉淀,后产生黑色沉淀 Ksp(ZnS)>Ksp(CuS) D 室温下,用pH试纸分别测定浓度均为0.1mol•L-1的Na2SO3和NaHSO3两种溶液的pH pH:Na2SO3>NaHSO3 结合H+能力比HSO-3的弱SO2-3组卷:30引用:3难度:0.5 -
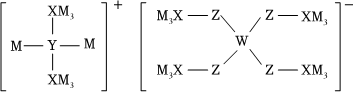 5.某多孔储氢材料结构如图,M、W、X、Y、Z五种短周期元素原子序数依次增大,Z比Y的原子序数大9。下列说法正确的是( )组卷:38引用:3难度:0.5
5.某多孔储氢材料结构如图,M、W、X、Y、Z五种短周期元素原子序数依次增大,Z比Y的原子序数大9。下列说法正确的是( )组卷:38引用:3难度:0.5 -
6.化学在生产、生活中起着重要的作用:
①明矾在水中可形成胶体,对水体进行杀菌净化;
②为了增强补铁药品的效果,可伴随维生素C共同使用;
③用米汤可检验加碘食盐中是否含有碘元素;
④将氯气通入氢氧化钙溶液反应制得漂白粉;
⑤侯氏制碱法中利用物质溶解度的不同,在液相中析出纯碱固体;
⑥复合膨松剂中常含酸性物质,可提高膨松效果。
其中叙述正确的个数有( )组卷:45引用:3难度:0.7
三、填空题
-
19.掺杂硒的纳米氧化亚铜催化剂可用于工业上合成甲醇,其反应为CO(g)+2H2(g)⇌CH3OH(g)ΔH=akJ•mol-1。已知:v正=k正•c(CO)•c2(H2),v逆=k逆•c(CH3OH),其中k正、k逆为速率常数,c为各组分的物质的量浓度。回答下列问题:
(1)若按=1的投料比将H2与CO充入VL的刚性恒容密闭容器中,在一定条件下发生反应,测定CO的平衡转化率与温度、压强的关系如图甲所示。n(H2)n(CO)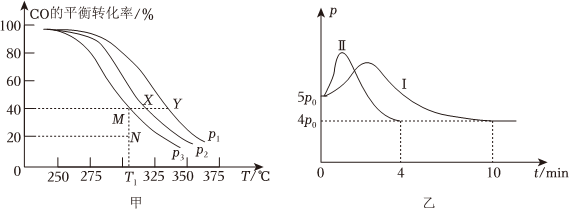
①压强p1、p2、p3由小到大的顺序是。
②T1℃,若向该容器中充入3.0mol H2和3.0mol CO发生上述反应,5min后反应达到平衡(M点),则0~5min内,v(H2)=mol•L-1•min-1,则N点的=k逆k正。
③X、Y、M、N四点,平衡常数从大到小关系是。
(2)若向起始温度为325℃的10L刚性恒容密闭容器中充入2mol CO和3mol H2,发生反应,体系总压强(p)与时间(t)的关系如图乙中曲线Ⅰ所示;曲线Ⅱ为只改变某一条件的变化曲线,曲线中平衡温度与起始温度相同。
①曲线Ⅱ所对应的改变的条件可能为。
②体系总压强先增大后减小的原因为。
③该条件下H2的平衡转化率为%。(结果保留一位小数)组卷:32引用:2难度:0.5 -
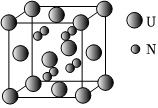 20.铀氮化合物是核燃料循环系统中的重要材料。
20.铀氮化合物是核燃料循环系统中的重要材料。
已知3(NH4)4[UO2(CO3)3]3UO2+10NH3↑+9CO2↑+N2↑+9H2O↑。回答下列问题:800℃
(1)基态氮原子价电子轨道表示式为。
(2)反应中断裂的化学键有(填标号)。
a.氢键
b.极性键
c.非极性键
d.离子键
e.配位键
(3)反应所得的气态产物中属于非极性分子的是(填化学式,下同);氢化物中更易与Cu2+形成配离子的是,解释原因。
(4)基态U原子的外围电子排布式为5f36d17s2,则处于下列状态的铀原子或离子失去一个电子所需能量最高的是(填标号)。
a.5f36d17s1
b.5f37s27p1
c.5f26d27s2
d.5f47s2
(5)的空间构型为CO2-3,其结构中存在大π键,可表示为(用πmn表示,m代表参与形成大π键的原子数,n代表参与形成大π键的电子数)。
(6)某种铀氮化物的晶胞如图。已知晶胞密度为dg•cm-3,U原子半径为r1nm,N原子半径为r2nm,设NA为阿伏加德罗常数的值,则该晶胞的空间利用率为(用含d、r1、r2、NA的式子表示)。组卷:63引用:3难度:0.5


